
Een vrouwelijke Noord-Pacifische reuzenoctopus (Enteroctopus dofleini) leeft drie tot vier jaar; Ze legt duizenden eieren in één keer en sterft dan. Daarentegen leeft een volwassen Sequoia sempervirens (Sequoia Redwood Tree) vele honderden jaren en produceert elk jaar miljoenen zaden (figuur 1). Zoals deze twee voorbeelden illustreren, verschillen organismen enorm in de manier waarop ze zich ontwikkelen, de tijd die ze nodig hebben om te groeien, wanneer ze volwassen zijn, hoeveel nakomelingen van een bepaalde grootte ze produceren, en hoe lang ze leven. Samen vormen de leeftijd-, grootte- of stadia-specifieke patronen van ontwikkeling, groei, rijping, voortplanting, overleving en levensduur de levenscyclus, de levensgeschiedenis, van een organisme.

Het belangrijkste doel van de levensgeschiedenistheorie, een tak van de evolutionaire ecologie, is het verklaren van de opmerkelijke diversiteit in levensgeschiedenissen onder soorten. Maar er is nog een andere, meer dwingende reden waarom levensgeschiedenisevolutie belangrijk is: aanpassing door natuurlijke selectie is gebaseerd op variatie in Darwinistische fitness tussen individuen, en aangezien levensgeschiedeniseigenschappen bepalend zijn voor overleving en voortplanting, zijn zij de belangrijkste componenten van fitness. De studie van de levensgeschiedenisevolutie gaat dus over het begrijpen van aanpassing, de meest fundamentele kwestie in de evolutiebiologie.
Hier introduceren we de grondbeginselen van de levensgeschiedenistheorie en bekijken we wat biologen over levensgeschiedenisevolutie hebben geleerd. Voor een meer diepgaande behandeling verwijzen we naar Stearns (1992), Roff (1992, 2002), Charlesworth (1994), en Flatt en Heyland (2011). Zie ook de Nature Education Knowledge artikelen van Shefferson (2010), Young (2010), en Fabian en Flatt (2011).
The Basics of Life History Theory
Life history theory seeks to explain how natural selection and other evolutionary forces shape organisms to optimize their survival and reproduction in the face of ecological challenges posed by the environment (Stearns 1992, Roff 1992, Stearns 2000), or as David Reznick has recently put it: “Life history theory predicts how natural selection should shape the way organisms parcel their resources into making babies” (Reznick 2010, p. 124). De theorie doet dit door het analyseren van de evolutie van fitheidscomponenten, zogenaamde life history traits, en hoe ze op elkaar inwerken: grootte bij geboorte; groeipatroon; leeftijd en grootte bij volwassenheid; aantal, grootte en geslacht van de nakomelingen; leeftijd-, fase- of groottespecifieke voortplantingsinspanning; leeftijd-, fase- of groottespecifieke overlevingskansen; en levensduur.
De klassieke theorie behandelt de levensgeschiedenisevolutie als een optimalisatieprobleem: gegeven bepaalde ecologische factoren (b.v. roofdieren, voeding) die de overlevings- en voortplantingskansen van een organisme beïnvloeden, en gegeven de beperkingen en compromissen die intrinsiek zijn aan het organisme, wat zijn de optimale waarden en combinaties van levensgeschiedeniseigenschappen die het voortplantingssucces maximaliseren? Om de oplossing voor dit probleem te vinden, moeten we de “randvoorwaarden” begrijpen (Stearns 2000): (1) hoe extrinsieke, omgevingsfactoren overleving en reproductie beïnvloeden; en (2) hoe intrinsieke verbanden tussen levensgeschiedeniskenmerken (trade-offs) en andere beperkingen beperken of en hoe levensgeschiedeniskenmerken kunnen evolueren. Zodra deze voorwaarden zijn begrepen en gedefinieerd, kunnen levensloopmodellen worden gebruikt om vragen te beantwoorden als: Hoe klein of groot moet een organisme worden? Op welke leeftijd en grootte moet het volwassen zijn? Hoe vaak moet het zich voortplanten? Hoeveel nakomelingen moet het voortbrengen en hoe groot moeten die zijn? Hoe lang moet het zich voortplanten en hoe lang moet het leven?
Life history optimization problems are typed by using the Euler-Lotka equation, which describes population growth rate (i.e., fitheid) van een klonaal genotype (of allelsubstitutie) in continue generatietijd als functie van zijn leeftijd bij volwassenheid, leeftijd bij laatste voortplanting, leeftijdsspecifieke overlevingskans, en het verwachte leeftijdsspecifieke aantal nakomelingen (Stearns 1992, Roff, 1992, Brommer 2000):
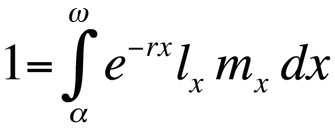
waarbij α de leeftijd bij de eerste voortplanting is, ω de leeftijd bij de laatste voortplanting, lx de overlevingskans vanaf de geboorte tot leeftijdsklasse x, mx het verwachte aantal nakomelingen in leeftijdsklasse x, en r het groeipercentage van de populatie of de Malthusiaanse parameter. De vergelijking sommeert de overlevings- en reproductiekansen over de gehele levensduur van de individuen in de populatie en kan dan worden opgelost voor r. Merk op dat in de context van de levensgeschiedenistheorie r de groeisnelheid of fitness van een kloon meet of, in zich seksueel voortplantende organismen, de verspreidingssnelheid van een allel dat de levensgeschiedenis beïnvloedt. De impliciete aanname is dus dat de gemodelleerde populatie bestaat uit fenotypisch en genetisch identieke individuen. Als de door de Euler-Lotka-vergelijking beschreven populatie stationair (niet-groeiend) is, is r nul en wordt de vergelijking
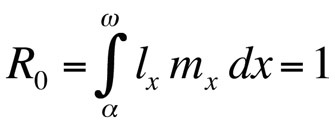
of, als de generatietijd discreet is,
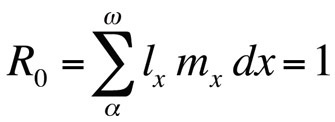
waarbij R0 het verwachte aantal dochters per vrouwtje per leven is (netto voortplantingspercentage). Deze vergelijking is eenvoudiger dan de continue-tijdversie en kan worden gebruikt wanneer r nul is of dicht bij nul ligt; voor stabiele populaties die niet in omvang veranderen, is R0 de geschikte fitnessmaatstaf (Stearns 1992, Roff 1992, Brommer 2000). Met behulp van dit kader kan men zich afvragen welke bepaalde combinatie van levensgeschiedeniskenmerken de fitness maximaliseert, of hoeveel de fitness wordt beïnvloed wanneer één van de kenmerken wordt veranderd. Deze benadering is met groot succes gebruikt om de evolutie van levensloopkenmerken te voorspellen.
Genetische variatie voor levensloopkenmerken
De evolutie van levensloopkenmerken door natuurlijke selectie hangt af van genetische variatie waarop selectie kan inwerken om aanpassingen aan de omgeving te produceren. De bovengenoemde modellen gaan er impliciet van uit dat de evolutie van de levensloop niet wordt beperkt door een gebrek aan genetische variatie. Interessant is echter dat de erfelijkheidsgraad (h2 = VA/VP = additieve genetische variantie gedeeld door fenotypische variantie), d.w.z. het deel van de fenotypische verschillen tussen individuen in een populatie dat wordt verklaard door additieve genetische verschillen tussen hen, gewoonlijk klein is voor levensgeschiedeniskenmerken. Deze lage erfelijkheidsgraad zou veroorzaakt kunnen worden door lage hoeveelheden additieve genetische variantie; toch bestaat er een ruime genetische variatie voor levensloopkenmerken in natuurlijke en laboratoriumpopulaties. In overeenstemming met de opvatting dat fitness-componenten veel genetische variatie herbergen, zijn vele kunstmatige selectie-experimenten in het laboratorium er met succes in geslaagd evolutionaire veranderingen in levensgeschiedeniskenmerken te veroorzaken in de voorspelde richting (Stearns 1992, Roff 1992, Houle 2001). Een van de redenen voor de grote variatie in levensgeschiedeniskenmerken kan zijn dat het zeer complexe, kwantitatieve, polygene kenmerken zijn die door vele loci worden beïnvloed (Houle 1992).
Maar hoe valt het te rijmen dat de VA groot is terwijl tegelijkertijd h2 klein is? Een waarschijnlijke reden voor de lage erfelijkheidsgraad van levensgeschiedeniskenmerken is dat, hoewel VA (de teller) groot is, VP (de noemer) veel groter is dan VA. De fenotypische variantie VP bestaat uit VA, de additieve genetische variantie, plus een rest, VR, die zelf bestaat uit alle niet-additieve genetische variatiebronnen (door dominantie, epistase, enz.) en fenotypische variatie die door de omgeving wordt veroorzaakt (fenotypische plasticiteit, interacties tussen genotype en omgeving; zie verder). Levensgeschiedeniskenmerken hebben dus waarschijnlijk een lage erfelijkheidsgraad omdat ze door veel loci worden beïnvloed (waardoor VA en VP worden opgeblazen), terwijl ze tegelijkertijd aanzienlijke hoeveelheden residuele variatie VR bevatten, bijvoorbeeld variatie als gevolg van veranderingen in de omgeving (waardoor VP wordt opgeblazen maar VA niet) (Houle 1992, Houle 2001).
Hoewel levensloopkenmerken onder sterke selectie staan, waardoor de genetische variatie zou moeten worden uitgeput, kunnen verschillende factoren de genetische variatie voor deze kenmerken in stand houden, waaronder het mutatie-selectie-evenwicht, heterogeniteit in het milieu en interacties tussen genotype en milieu, en negatieve genetische correlaties (Stearns 1992, Roff 1992, Houle 2001). Maar ondanks de grote variatie in levensgeschiedenis is de evolutie van de levensgeschiedenis ook onderhevig aan beperkingen.
Life History Trade-Offs and Other Constraints
Fitness would obviously be maximal if survival and reproduction would be maximal at all ages, stages, or sizes of an organism. In principe is het basisprobleem van de levensgeschiedenisevolutie dan triviaal: alle levensgeschiedeniseigenschappen zouden altijd zo moeten evolueren dat overleving en reproductie, en dus fitness, gemaximaliseerd worden (Houle 2001). Dit zou zeer snel leiden tot de evolutie van “Darwinistische demonen” (Law 1979) die de wereld zouden overnemen, d.w.z. organismen die zich meteen na hun geboorte beginnen voort te planten, een oneindig aantal nakomelingen produceren, en eeuwig leven. Dergelijke organismen bestaan echter niet in de echte wereld: De hulpbronnen zijn eindig, en levensloopkenmerken zijn onderhevig aan intrinsieke afwegingen en andere soorten beperkingen, zodat natuurlijke selectie de levensloopkenmerken – en dus de fitness – niet kan maximaliseren voorbij bepaalde grenzen. We noemen dergelijke grenzen evolutionaire beperkingen (Stearns 1992, Houle 2001); zoals hierboven vermeld, vertegenwoordigen ze de intrinsieke “randvoorwaarde” die we moeten begrijpen om de evolutie van de levensgeschiedenis te voorspellen.
Een van de belangrijkste soorten beperkingen zijn de “life history trade-offs” (Stearns 1992, Roff 1992, Flatt en Heyland 2011). Er is sprake van een trade-off wanneer een toename in een eigenschap van de levensgeschiedenis (die de fitness verbetert) gepaard gaat met een afname in een andere eigenschap van de levensgeschiedenis (die de fitness vermindert), zodat het fitnessvoordeel door een toename in eigenschap 1 wordt afgewogen tegen de fitnesskosten door een afname in eigenschap 2 (figuur 2A). (Merk op dat trade-offs ook meer dan twee eigenschappen kunnen omvatten.) Op genetisch niveau wordt gedacht dat dergelijke trade-offs worden veroorzaakt door allelen met antagonistische pleiotrope effecten of door linkage disequilibrium tussen loci.
Trade-offs worden typisch beschreven door negatieve fenotypische of genetische correlaties tussen fitnesscomponenten tussen individuen in een populatie (figuur 2A). Als de relatie genetisch is, wordt voorspeld dat een negatieve genetische correlatie de evolutie van de betrokken eigenschappen beperkt (d.w.z. vertraagt of voorkomt). Er is dus sprake van een genetische wisselwerking in een populatie wanneer een evolutionaire verandering in een eigenschap die de fitness verhoogt, gepaard gaat met een evolutionaire verandering in een andere eigenschap die de fitness verlaagt. Het bestaan van genetische correlaties kan worden vastgesteld door middel van kwantitatieve genetische kweekontwerpen of door middel van gecorreleerde fenotypische reacties op selectie. Bijvoorbeeld, directe kunstmatige selectie voor een langere levensduur in genetisch variabele laboratoriumpopulaties van fruitvliegen (Drosophila melanogaster) veroorzaakt de evolutie van een langere volwassen levensduur (soms in 10 of minder generaties), maar deze evolutionaire toename van de levensduur gaat gepaard met een verminderde vroege reproductie (b.v. Zwaan et al. 1995). Dit suggereert dat levensduur en vroege reproductie genetisch negatief gekoppeld zijn, bijv. door antagonistische pleiotrope allelen (bijv. Flatt 2011, Fabian en Flatt 2011).
Op fysiologisch niveau worden trade-offs veroorzaakt door competitieve allocatie van beperkte hulpbronnen aan de ene levensgeschiedenis eigenschap versus de andere binnen een enkel individu, bijvoorbeeld wanneer individuen met een hogere reproductieve inspanning een kortere levensduur hebben of vice versa (Figuur 2B). Een nuttige manier om na te denken over handel in middelen is zich een levensgeschiedenis voor te stellen als een eindige taart, waarbij de verschillende stukken vertegenwoordigen hoe een organisme zijn middelen verdeelt over groei, opslag, onderhoud, overleving en voortplanting (Reznick 2010; figuur 2C). Het essentiële probleem is dit: gegeven de ecologische omstandigheden, en het feit dat het groter maken van één schijfje betekent dat een ander schijfje kleiner wordt, wat is dan de beste manier om de taart te verdelen? Aangezien afwegingen bij de toewijzing van hulpbronnen een genetische basis kunnen hebben, en verschillende genotypen kunnen verschillen in aspecten van de toewijzing van hulpbronnen, zijn de genetische en fysiologische opvattingen over afwegingen niet noodzakelijkerwijs onverenigbaar. Fysiologische afwegingen op individueel niveau vertalen zich echter niet altijd in genetische (evolutionaire) afwegingen op populatieniveau. Bijvoorbeeld, wanneer de fysiologische (binnen-individuele) trade-off genetisch gefixeerd is (“hard-wired”) onder alle individuen binnen de populatie, zullen alle individuen dezelfde negatieve fysiologische relatie vertonen tussen twee levensgeschiedeniskenmerken, maar de genetische correlatie tussen individuen zou nul zijn (Stearns 1989, Stearns 1992).
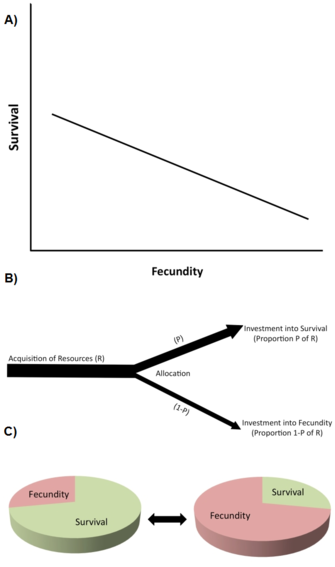
In het boek van Stearns (1992) worden 45 mogelijke compromissen tussen 10 belangrijke levensloopkenmerken opgesomd, en er zijn er nog veel meer denkbaar. Tot de compromissen die de meeste aandacht hebben gekregen, behoren (1) huidige reproductie versus overleving; (2) huidige versus toekomstige reproductie; (3) huidige reproductie versus ouderlijke groei; (4) huidige reproductie versus ouderlijke conditie; en (5) aantal versus grootte van de nakomelingen.
Enkele van de beste bewijzen voor genetisch gebaseerde levensgeschiedenis trade-offs zijn afkomstig van kunstmatige selectie en experimentele evolutie-experimenten uitgevoerd in Drosophila (zie reviews in Stearns en Partridge 2001, Flatt en Schmidt 2009, Flatt 2011). Samenvattend hebben veel experimenten het volgende gevonden: een negatieve correlatie tussen vroege vruchtbaarheid en volwassen levensduur; een positieve correlatie tussen ontwikkelingstijd en lichaamsgrootte; een positieve correlatie tussen ofwel ontwikkelingstijd ofwel lichaamsgrootte met vroege vruchtbaarheid; en een negatieve correlatie tussen vroege en late vruchtbaarheid.
Andere beperkingen van de levensgeschiedenis die natuurlijke selectie verhinderen een bepaald fitness optimum te bereiken, kunnen te maken hebben met biofysische, biochemische en structurele factoren, ontwikkelingseigenschappen van het organisme, fylogenetische en historische omstandigheden, of simpelweg een gebrek aan genetische variatie (Stearns 1992, Houle 2001).
Phenotypische plasticiteit in levensgeschiedeniskenmerken
Genetische variatie en beperkingen zijn niet de enige factoren die van invloed zijn op de expressie en evolutie van levensgeschiedeniskenmerken. Een andere belangrijke kwestie is dat variatie in levensgeschiedenis vaak sterk wordt beïnvloed door de omgeving (b.v. temperatuur, voeding, predatoren), een fenomeen dat fenotypische plasticiteit wordt genoemd, d.w.z. het vermogen van één genotype (of kloon) om in verschillende omgevingen verschillende fenotypen te produceren (Stearns 1992, Roff 1997, Pigliucci 2001, DeWitt en Scheiner 2004). De plasticiteit van een specifiek genotype kan conceptueel worden beschreven door een wiskundige functie die reactienorm wordt genoemd, d.w.z. een lijn of kromme die de door dit genotype geproduceerde fenotypes relateert aan veranderingen in de omgeving die het ondergaat (figuur 3A).
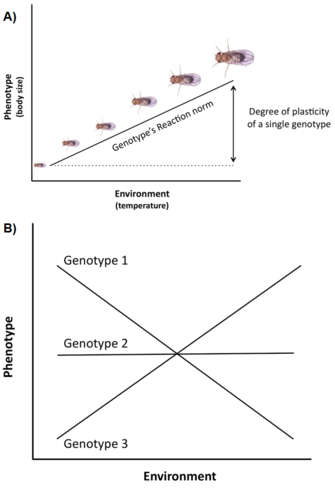
Het belang van dergelijke plasticiteit in de levensgeschiedenisevolutie is ten minste drieledig (Stearns en Koella 1986, Stearns et al. 1991, Stearns 1992, Nylin en Gotthard 1998, DeWitt en Scheiner 2004, Flatt 2005): (1) aangezien plasticiteit de fenotypische expressie van genetische variatie voor enkele levensgeschiedeniskenmerken en van genetische correlaties voor paren van kenmerken moduleert, beïnvloedt het de genetische respons op selectie over de omgevingen heen; (2) als er adaptieve variatie tussen genotypes voor de plastic respons bestaat, kan selectie een optimale reactienorm produceren die fitness over de omgevingen heen maximaliseert; en (3) plasticiteit van een specifiek kenmerk kan het organisme homeostatisch bufferen tegen door het milieu veroorzaakte veranderingen in andere kenmerken, zodat de prestaties van het organisme en dus de fitness geoptimaliseerd is.
Veel levensloopkenmerken (b.v, leeftijd bij volwassenheid, fecunditeit) vertonen een hoge mate van plasticiteit, en er is vaak aanzienlijke genetische variatie voor plasticiteit in natuurlijke populaties, dat wil zeggen genotypen hebben verschillende reactienormen, een fenomeen dat genotype door omgeving interactie (GxE) (figuur 3B). Bovendien kunnen niet alleen afzonderlijke kenmerken maar ook correlaties tussen kenmerken plastisch zijn, en verschillende milieus kunnen de helling en/of het teken van de kenmerkcorrelatie veranderen (Stearns et al. 1991, Stearns 1992). Bij spadefoot padden (Scaphiophus couchii), bijvoorbeeld, hebben individuen die zich ontwikkelen in vijvers van korte duur een kortere larvale periode en een kleinere lichaamsgrootte bij metamorfose (waarbij de kenmerken negatief gecorreleerd zijn) dan individuen die zich ontwikkelen in vijvers van lange duur (waarbij de kenmerken positief gecorreleerd zijn) (Newman 1988, Stearns et al. 1991).
Na bespreking van de optimaliteitsmodellering en de factoren die de expressie van levensgeschiedeniskenmerken beïnvloeden, bespreken we nu enkele belangrijke voorspellingen voor de evolutie van levensgeschiedenissen (voor details zie Stearns 1992, Roff 1992, Charlesworth 1994, Stearns 2000, Roff 2002).
Voorspellingen voor de evolutie van levensgeschiedeniskenmerken
Op welke leeftijd en grootte moet een organisme volwassen worden? Het voortplantingssucces van een genotype hangt sterk af van zijn groeisnelheid en – als gevolg van de groei – van zijn leeftijd en grootte bij volwassenheid. Om de optimale leeftijd en grootte bij volwassenheid te voorspellen, moeten we de relatieve kosten en baten (in termen van sterfte en voortplanting) begrijpen van vroegtijdig of laat volwassen worden en van groot worden of klein blijven. De baten van de ene “strategie” zijn de kosten van de andere, en omgekeerd. De voordelen van vroeger volwassen worden en een kleinere omvang (d.w.z. de kosten van later volwassen worden en een grotere omvang) omvatten (1) een grotere kans op overleving tot de volwassenheid door een kortere duur van de risicovolle ontwikkelings- en opgroeiperiode, en (2) een kortere generatietijd, waardoor de ouders eerder geboren nakomelingen kunnen voortbrengen, die zich ook eerder beginnen voort te planten. Zo zou bijvoorbeeld een hoge jeugdsterfte de evolutie naar vroegere rijpheid in de hand moeten werken. Omgekeerd omvatten de voordelen van later volwassen worden en een grotere omvang (d.w.z. de kosten van vroeger volwassen worden en een kleinere omvang) (1) een langere groei die leidt tot een grotere grootte bij volwassenheid en dus een hogere vruchtbaarheid (aangezien de vruchtbaarheid vaak toeneemt met de grootte), (2) een lagere volwassen sterfte (en dus een potentieel hogere levenslange vruchtbaarheid) als gevolg van een grotere grootte (de sterfte als gevolg van roofdieren is vaak lager voor grotere individuen), en (3) een hogere kwaliteit van de nakomelingen (bijvoorbeeld een hogere investering per nakomeling, een betere ouderlijke zorg), waardoor de overleving van de geproduceerde nakomelingen verbetert.
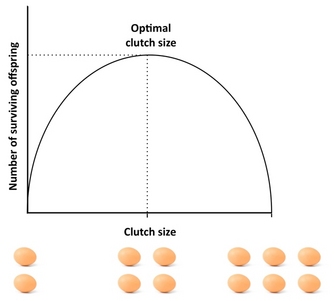
Hoeveel nakomelingen moet een organisme produceren? Een goed uitgangspunt om deze vraag te beantwoorden is het “Lack-koppel”, een concept dat teruggaat op de ornitholoog David Lack (1947). Lack’s basisinzicht was dat vogels hun legselgrootte moeten optimaliseren door het aantal uitgevlogen (overlevende) nakomelingen te maximaliseren. Afwijkingen van deze optimale legselgrootte zouden het voortplantingssucces verminderen: als de ouders een te groot legsel produceren, kan het zijn dat zij niet in staat zijn al hun nakomelingen te onderhouden en groot te brengen, en dat sommige of alle nakomelingen sterven, terwijl als zij een te klein legsel produceren, het aantal uitgevlogen nakomelingen lager kan zijn dan wat de ouders kunnen onderhouden (figuur 4). Hoewel Lack gelijk had met zijn bewering dat fitness vaak gemaximaliseerd wordt bij intermediaire investeringen, zijn de legselgroottes typisch kleiner dan wat het Lack legsel voorspelt. Dit komt doordat het concept verschillende factoren negeert die de legselgrootte kunnen reduceren, waaronder oudersterfte, toekomstige voortplanting, de snelheid van kleinkinderenproductie, en ouder-nakomelingenconflicten. Het bestaan van compromissen tussen de huidige reproductie en de overleving van de ouders, de huidige en toekomstige reproductie, of het aantal en de grootte van de nakomelingen kunnen afwijkingen van het Lack legsel veroorzaken, en modellen die met dergelijke factoren rekening houden geven meestal een betere overeenkomst met de waargenomen legselgrootte dan het Lack legsel. Voor een uitstekende empirische studie van de optimale legselgrootte zie de studie van Daan et al. (1990) over Europese torenvalken.
Hoe vaak moet een organisme zich voortplanten? Moet het semelparous zijn (d.w.z. zich slechts één keer voortplanten) of iteroparous (d.w.z. zich meerdere keren voortplanten) (figuur 5; zie ook Young 2010)? Theorie suggereert dat iteropariteit en de evolutie van verhoogde reproductieve levensduur worden begunstigd wanneer volwassen overleving hoog is en wanneer volwassen vruchtbaarheid of juveniele overleving laag is: hoge (of niet-variabele) volwassen overleving verhoogt het aantal reproductieve gebeurtenissen per leven, en lage (of variabele) vruchtbaarheid of juveniele overleving veroorzaken fitness verliezen die selecteren voor verhoogde compenserende reproductieve inspanning. Omgekeerd, worden semelparity en de evolutie van verminderde reproductieve levensduur bevorderd wanneer de volwassen overleving laag is en de overleving van de jongen hoog is. Aldus, bevordert de hoge (of niet-variabele) volwassenheid ten opzichte van jeugdoverleving iteropariteit en verlengt reproductieve levensduur terwijl de hoge (of veranderlijke) volwassenheid ten opzichte van jeugdsterfte semelpariteit bevordert en reproductieve levensduur verkort. Semelparous organismen hebben meestal een hogere reproductieve inspanning dan iteroparous organismen.

De bovenstaande overwegingen zijn aspecten van een algemener vraagstuk dat het “algemene levensgeschiedenisprobleem” of “voortplantingsinspanningsmodel” wordt genoemd (Schaffer 1983, Stearns 1992, Roff 1992, Charlesworth 1994): gegeven het feit dat voortplanting zowel voordelen heeft (d.w.z, nakomelingenproductie) en kosten (b.v. verminderde toekomstige reproductie, verhoogde ouder- of nakomelingensterfte), wat is de optimale reproductie-investering die de fitness maximaliseert? Vele theoretische en empirische studies hebben zich over dit probleem gebogen; enkele van de belangrijkste conclusies van dit werk zijn (zie Stearns 1992, Roff 1992, Charlesworth 1994): (1) de voortplantingsinspanning neemt vaak, maar niet altijd, toe met de leeftijd omdat de kosten van de huidige voortplanting in termen van toekomstige voortplanting naar verwachting afnemen met de leeftijd (aangezien het aantal toekomstige voortplantingsgebeurtenissen waarin de kosten zich kunnen manifesteren, afneemt met de leeftijd); (2) als de voortplantingsinspanning afnemende opbrengsten oplevert of als de mortaliteit toeneemt naarmate de inspanning toeneemt, wordt de voorkeur gegeven aan intermediaire voortplantingsinvesteringen en iteropariteit; (3) als de sterfte in alle leeftijdsklassen toeneemt, neemt de reproductie-inspanning toe in de vroege levensjaren en neemt de leeftijd bij volwassenheid af; evenzo zou, als de sterfte onder volwassenen toeneemt, de leeftijd bij volwassenheid moeten afnemen; en (4) als de sterfte na een bepaalde leeftijd (of in één specifieke leeftijdsklasse) toeneemt, neemt de reproductie-inspanning toe vóór en af na die leeftijd. Als bijzonder mooie tests van dergelijke voortplantingsinspanningsmodellen verwijzen we de lezer naar de veld- en laboratoriumexperimenten van David Reznick en collega’s op Trinidad guppy’s (bijv. Reznick et al. 1990).
Hoe lang moet een organisme leven (zie ook Fabian en Flatt 2011)? De evolutie van de levensduur kan worden gezien als een evenwicht tussen selectie voor een langere reproductieve levensduur (en dus mogelijk een groter reproductief succes) en veroudering (d.w.z. een intrinsieke leeftijdsafhankelijke toename van de mortaliteit). De voordelen van de evolutie van een langere reproductieve levensduur omvatten (zie ook hierboven): (1) een hoger aantal reproductieve gebeurtenissen (en dus nakomelingen) per leven als de extrinsieke volwassen sterfte laag is, (2) voldoende tijd om reproductief te compenseren voor nakomelingen die verloren gaan als gevolg van hoge juveniele sterfte, en (3) verminderde reproductieve onzekerheid als gevolg van hoge variatie in juveniele sterfte van de ene voortplantingsronde tot de volgende, opnieuw door de mogelijkheid om verloren nakomelingen te compenseren. Deze effecten worden tenietgedaan door de effecten die de volwassen sterfte verhogen (b.v. overlevingskosten van de voortplanting; veroudering) ten opzichte van de jeugdsterfte. Verhogingen van het gemiddelde (en/of de variantie) van de volwassen sterfte ten opzichte van de juveniele sterfte leiden dus tot een kortere reproductieve levensduur en semelariteit, terwijl dalingen van het gemiddelde (en/of de variantie) van de volwassen sterfte ten opzichte van de juveniele sterfte leiden tot een langere reproductieve levensduur en iteropariteit.
Veel van deze voorspellingen van de levensgeschiedenistheorie worden tegenwoordig door bewijzen ondersteund; wij zullen dit artikel besluiten met een voorbeeld van een bijzonder elegant experiment dat de belangrijkste voorspellingen van het “algemene levensgeschiedenisprobleem” heeft bevestigd.
Een voorbeeld van een empirische test van de theorie
Om de basisprincipes van de levensgeschiedenistheorie te testen, gebruikten Stearns et al. (2000) een outbred populatie van fruitvliegen (D. melanogaster) om twee reeksen van repliceerbare “experimentele evolutie” lijnen te creëren: drie lijnen werden blootgesteld aan een hoge volwassen sterfte behandeling (HAM; door willekeurig 90% van de vliegen twee keer per week te doden) en drie lijnen aan een lage volwassen sterfte behandeling (LAM; door 10% van de vliegen twee keer per week te doden). Na vier jaar van experimentele evolutie onder deze omstandigheden in het labo, maten Stearns en medewerkers de levensgeschiedenisfenotypes van alle lijnen in beide behandelingen om de evolutionaire reacties van de vliegen op hoge versus lage extrinsieke mortaliteit te onderzoeken. De resultaten van dit lange-termijn experiment waren zowel duidelijk als intrigerend, en bevestigden de theoretische voorspellingen: fruitvliegen die waren geëvolueerd onder HAM omstandigheden ontwikkelden zich sneller als larven, sloten zich eerder en op een kleinere grootte als volwassenen, hadden een hogere vroege piek fecunditeit, en vertoonden een kortere levensduur dan de LAM vliegen die het tegenovergestelde pakket van aanpassingen evolueerden. Met andere woorden, vliegen die evolueren in een zeer gevaarlijke omgeving reageerden evolutionair door hun ontwikkeling te versnellen, hun leeftijd en grootte bij volwassenheid te verminderen, meer eieren vroeger te leggen, en korter te leven: ze pasten zich aan aan hoge niveaus van toevallige sterfte door hun voortplantingsinspanning te verschuiven naar vroegere leeftijden en door hun hele levensloop te comprimeren in een kortere levensduur. Vergelijkbaar met de bevindingen van Reznick et al. (1990) bij guppy’s, bevestigen deze resultaten dus de belangrijkste voorspellingen van de levensgeschiedenistheorie, in het bijzonder de belangrijke rol van extrinsieke volwassen sterfte in het vormgeven van de evolutie van groei, rijping, voortplanting en veroudering.
Samenvatting
Hier hebben we de grondbeginselen van de levensgeschiedenistheorie geïntroduceerd. Levensgeschiedenistheorie probeert te begrijpen hoe natuurlijke selectie organismen ontwerpt om reproductief succes te bereiken, gegeven kennis van hoe selectieve factoren in de omgeving (d.w.z. extrinsieke sterfte) en factoren intrinsiek aan het organisme (d.w.z., afwegingen, beperkingen) overleving en voortplanting beïnvloeden. Door gebruik te maken van een verscheidenheid aan theoretische en empirische methoden, en in het bijzonder door het optimaliteitsdenken toe te passen, hebben levensgeschiedenistheoretici belangrijke voorspellingen afgeleid over de evolutie van de belangrijkste levensloopkenmerken, waaronder leeftijd en grootte bij volwassenheid, het aantal en de grootte van de nakomelingen, leeftijd- of groottespecifieke reproductieve inspanning, reproductieve levensduur en veroudering. Op basis van deze voorspellingen en door ze te testen in veld- en laboratoriumexperimenten, bijvoorbeeld met vliegen, vissen of vogels, hebben levensgeschiedenisbiologen ons een aantal overtuigende antwoorden gegeven op fundamentele vragen als: Hoe snel moet een organisme zich ontwikkelen? Op welke leeftijd en grootte moet het volwassen zijn? Hoeveel nakomelingen moet het krijgen en hoe groot moeten die zijn? Moet het zich één keer of meerdere keren voortplanten? En hoe lang moet het leven? Door deze problemen aan te pakken heeft de levensgeschiedenistheorie een grote invloed gehad op ons begrip van aanpassing door natuurlijke selectie, de meest fundamentele kwestie in de gehele evolutiebiologie.