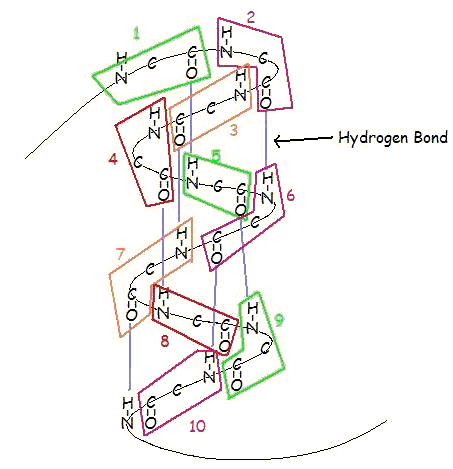
Een α-helix is een rechtshandige spiraal van aminozuurresiduen op een polypeptideketen, meestal variërend tussen 4 en 40 residuen. Deze spiraal wordt bijeengehouden door waterstofbruggen tussen de zuurstof van C=O op de bovenste spoel en de waterstof van N-H op de onderste spoel. Zo’n waterstofbrug wordt precies elke 4 aminozuurresiduen gevormd, en elke volledige draai van de helix is slechts 3,6 aminozuurresiduen. Dit regelmatige patroon geeft de α-helix zeer duidelijke kenmerken met betrekking tot de dikte van de spiraal en de lengte van elke volledige draai langs de helix-as.
De structurele integriteit van een α-helix is deels afhankelijk van de juiste sterische configuratie. Aminozuren met te grote R-groepen (tryptofaan, tyrosine) of te kleine R-groepen (glycine) destabiliseren α-helixen. Proline destabiliseert α-helixen ook vanwege zijn onregelmatige geometrie; zijn R-groep bindt terug naar de stikstof van de amidegroep, wat sterische hinder veroorzaakt. Bovendien verhindert het ontbreken van een waterstof op de stikstof van Proline dat het deelneemt aan waterstofbruggen.
Een andere factor die de stabiliteit van α-helixen beïnvloedt, is het totale dipoolmoment van de hele helix als gevolg van de individuele dipolen van de C=O-groepen die betrokken zijn bij waterstofbruggen. Stabiele α-helixen eindigen meestal met een geladen aminozuur om het dipoolmoment te neutraliseren.