Een systeem verwijst naar elk deel van het universum dat wordt bestudeerd.
Als je een experiment uitvoert in een bekerglas, dan bevindt het systeem dat je bestudeert zich in het bekerglas.
Het systeem is onderhevig aan omgevingsfactoren zoals luchttemperatuur en luchtdruk.
Thermodynamica betreft de studie van de uitwisseling van warmte-energie tussen een systeem en zijn omgeving.
Er zijn drie soorten thermodynamische systemen. Op basis van de mogelijke overdracht van warmte en materie worden ze geclassificeerd als open, gesloten of geïsoleerde systemen.
Typen thermodynamische systemen
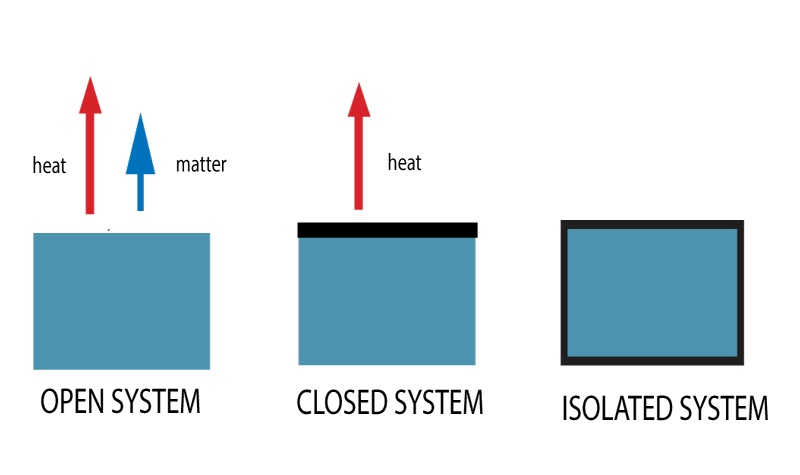
Open systemen
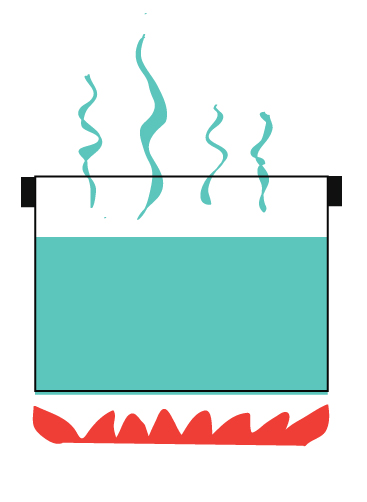
Je hebt misschien wel eens gehoord van open systemen en gesloten systemen. Een open systeem is een systeem waarin zowel energie als materie vrijelijk in en uit het systeem kunnen stromen.
Bijv. kokend water zonder deksel.
Warmte die in de lucht ontsnapt.
Stoom (dat materie is) dat in de lucht ontsnapt.
Gesloten systemen
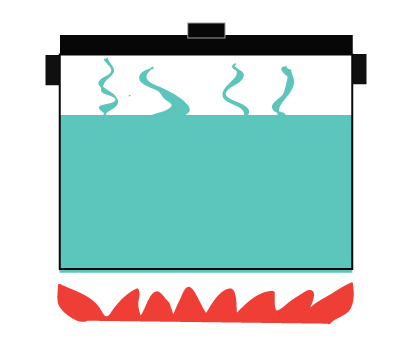
Een gesloten systeem daarentegen staat geen uitwisseling van materie toe, maar staat wel toe dat energie wordt overgedragen.
Het staat toe dat warmte wordt overgedragen van het fornuis naar het water
Warmte wordt ook overgedragen aan de omgeving
Stoom mag niet ontsnappen
Voorbeeld van een gesloten systeem – een snelkookpan.
Nb: If a system is 100% closed, it is in danger of exploding. That's why a pressure cooker should be designed with safety mechanisms to prevent the system from over-pressurzing by allowing steam to escape when needed.
Gesloten systemen
Dit systeem is volledig gesloten.
Er kan geen materie of warmte naar of uit de omgeving worden overgedragen.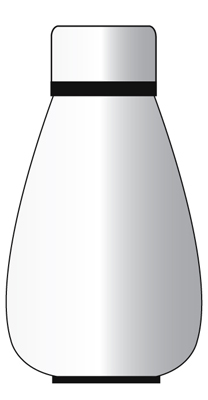 Voorbeeld – Een thermosfles.
Voorbeeld – Een thermosfles.
Het doel van een thermosfles is om je eten warm te houden.
Een thermosfles kan worden beschouwd als een geïsoleerd systeem, maar slechts voor korte tijd.
Het voorkomt dat zowel warmte als materie aan de omgeving wordt overgedragen.
Uiteindelijk zal de warmte in de thermosfles aan de omgeving ontsnappen en zal de inhoud in de thermosfles worden afgekoeld.