Glycogenolyse, of glycogeenafbraak, maakt glucose vrij wanneer het nodig is.
In de lever is glycogeen een glucose-reserve voor het handhaven van normale bloedglucosewaarden, en de afbraak ervan vindt voornamelijk plaats:
- in nuchtere toestand, bijv. tijdens het nachtelijk vasten;
- tussen de maaltijden;
- tijdens een zeer intensieve lichamelijke activiteit.
In hepatocyten wordt glycogenolyse gestimuleerd door glucagon en adrenaline, geremd door insuline, en onderhevig aan negatieve allosterische regulatie door glucose (zie hieronder).
In de spieren is glycogeen een energiebron voor spieractiviteit; daarom vindt glycogeenafbraak plaats tijdens contractie, en alleen in spieren die betrokken zijn bij de activiteit.
In spiercellen wordt glycogenolyse gestimuleerd door adrenaline, en gereguleerd door positieve en negatieve allosterische effectoren, respectievelijk AMP en calciumion (Ca2+), en ATP en glucose-6-fosfaat (zie hieronder).
CONTENTEN
- Stappen van de glycogenolyse
- Metabolische bestemming van glucose-1-fosfaat in spier en lever
- Covalente regulering van de glycogenolyse in spier en lever
- β-Adrenerge receptoren
- Stimulerende G-eiwitten
- Adenyl cyclase
- Protein kinase A
- Fosforylase kinase
- Spier fosforylase kinase
- Hepatic fosforylase kinase
- Spierglycogeenfosforylase
- Allosterische regulatie van PP1
- Hepatisch glycogeenfosforylase
- glucose 1-fosfaat (ongeveer 90% van de vrijgekomen glucosemoleculen);
- een kleine hoeveelheid vrije glucose, de resterende 10% ;
- een kleiner en minder vertakt glycogeenmolecuul.
- adrenaline (ook bekend als epinefrine), geproduceerd door de bijnieren, dat onder andere werkt op spier-, lever- en vetcellen;
- glucagon, geproduceerd door alfacellen van de alvleesklier, dat werkt op hepatocyten en adipocyten.
- een toename van de glycogeenafbraak in spier- en levercellen;
- een toename van de triglycerideafbraak (lipolyse) in vetweefsel.
- glycogeensynthase (EC 2.4.1.11), geremd;
- hormoongevoelig lipase (EC 3.1.1.79), geactiveerd;
- fosfofructokinase 2/fructose-2,6-bisfosfatase (EC 2.7.1.105 en EC 3.1.3.46 respectievelijk), geactiveerd;
- inhibitor-1 en de glycogeen-bindende (G)-subeenheid van proteïnefosfatase 1, geactiveerd;
- fosforylase kinase, geactiveerd.
- T, voor gespannen of strak, die minder actief is;
- R, voor ontspannen, die actiever is, en in staat om zich te binden aan glycogeen, ook in de gefosforyleerde toestand (zie hieronder).
- G-subeenheid, die, in de gefosforyleerde vorm, niet in staat is om de katalytische subeenheid van PP1 te binden, en daarom ontmoet PP1 niet zijn glycogeen-geassocieerde doelen (omgekeerd, G-subeenheid fosforylering geïnduceerd door insuline stimulatie, die diverse aminozuur residuen beïnvloedt, maakt de binding aan de katalytische subeenheid van PP1 mogelijk);
- inhibitor-1, die in gefosforyleerde vorm in staat is de activiteit van PP1 te remmen.
- Als een cel met voldoende energie het hormonale signaal ontvangt dat de cascade van activeringen op gang brengt, blijft glycogeen fosforylase b, geremd door ATP en glucose-6-fosfaat, in de T-toestand totdat de lading hoog is.
- Als de cellulaire energielading laag is, begint glycogeen fosforylase b, geactiveerd door AMP, met de afbraak van glycogeen, zelfs bij afwezigheid van de hormonale stimulus die de omzetting in de actieve a-vorm induceert.
- Het eerste verschil betreft de reactie op AMP: hepatisch glycogeenfosforylase b wordt niet geactiveerd door AMP.
- Het tweede verschil betreft glycogeenfosforylase a: het enzym wordt geremd door glucose, dat een competitieve remmer is (de monosacharide verschuift het allosterisch evenwicht in de richting van de inactieve T-toestand van de a-vorm.
Allosterische regulatie van glycogenolyse in spier en lever
Stappen van glycogenolyse
Glycogenolyse begint door de werking van glycogeenfosforylase (EC 2.4.1.1), een homodimeer dat voor zijn activiteit de aanwezigheid van pyridoxal-5-fosfaat vereist, een derivaat van pyridoxine of vitamine B6. Het enzym katalyseert de fosfolytische splitsing van de α-(1,4)-glycosidebinding, waarbij glucosemoleculen één voor één vrijkomen van de niet-reducerende uiteinden, d.w.z. de uiteinden met een vrije 4′-OH-groep, van de externe takken. Deze reactie, die geen ATP maar een orthofosfaat verbruikt, levert glucose-1-fosfaat op.
Glycogeen(n glucoseresiduen) + Pi → Glucose-1-fosfaat + Glycogeen(n-1 glucoseresiduen)
Note: in de dunne darm katalyseert pancreatisch α-amylase (EC 3.2.1.1) de hydrolytische splitsing van de α-(1,4) glycosidebindingen van het zetmeel en levert glucosemoleculen.
In vivo katalyseert glycogeenfosforylase een irreversibele fosfolyse, een bijzonder voordelige reactie voor skeletspieren en het hart (zie hieronder). De onomkeerbaarheid van de reactie wordt verzekerd door de verhouding /, die gewoonlijk groter is dan 100. Omgekeerd is de reactie in vitro gemakkelijk omkeerbaar.
Glycogeen fosforylase werkt repeterend op de niet-reducerende uiteinden van takken, en komt tot stilstand als de glucose-eenheid die 4 residuen verwijderd is van het vertakkingspunt wordt bereikt: dit is de buitengrens van de grens dextrine. Op dit punt voltooien twee enzymatische activiteiten, aanwezig op dezelfde polypeptideketen, de glycogeenafbraak: het α-(1,4)-glucan-6-glycosyltransferase (EC 2.4.1.24) en het amylo-α-(1,6)-glucosidase of debranching-enzym (EC 3.2.1.33). De eerste enzymatische activiteit brengt drie van de resterende vier glucose-eenheden van de tak over naar het niet-reducerende uiteinde van een andere tak, waardoor in de eerste keten slechts één glucose-eenheid overblijft, die met een α-(1,6)-glycosidebinding aan de keten is gebonden. De tweede enzymatische activiteit hydrolyseert deze α-(1,6)-glycoside binding, waarbij glucose vrijkomt en een onvertakte keten van α-(1,4)-gekoppelde glucose-eenheden.
Zonder de vertakking kan glycogeenfosforylase doorgaan met het verwijderen van glucose-eenheden tot het de volgende grensdextrine bereikt.
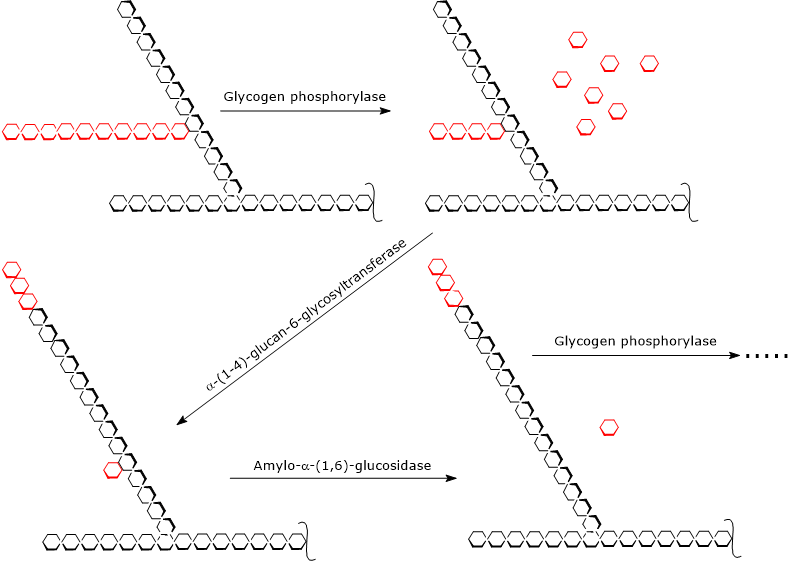
De producten van de reacties die door de drie enzymatische activiteiten worden gekatalyseerd, zijn dan ook:
Metabolische lotgevallen van glucose-1-fosfaat in spier en lever
Glucose-1-fosfaat is een geladen molecuul, en daarom zit het vast in de cel.
Het wordt omgezet in glucose-6-fosfaat in de reactie die wordt gekatalyseerd door fosfoglucomutase (EC 5.4.2.2), hetzelfde enzym dat ook tussenbeide komt in de glycogeensynthese door glucose-6-fosfaat om te zetten in glucose-1-fosfaat. Dit enzym katalyseert een omkeerbare reactie: de richting wordt bepaald door de relatieve concentraties van de twee moleculen, en in dit geval verplaatst de fosfaatgroep zich van C1 naar C6.
Glucose 1-fosfaat ⇄ Glucose 6-fosfaat
In de spier, en in de meeste andere organen en weefsels, komt glucose uit de glycogenolyse in de glycolyse terecht als glucose 6-fosfaat, waarbij de activeringsstap die door hexokinase wordt gekatalyseerd, wordt omzeild. Daarom spaart glycogeenfosforylase, dat een reeds “geactiveerd” glucosemolecuul vrijgeeft, een ATP. Een ATP-molecuul is nodig om een ander glycolytisch tussenproduct te synthetiseren, het fructose 1,6-bisfosfaat.
Op deze manier wordt een deel van de activeringsenergie die nodig is voor de glycogeensynthese behouden: de netto opbrengst van ATP per glucosemolecuul door glycolyse tot lactaat is 3 in plaats van 2, een voordeel voor de werkende spier. De algemene vergelijking is:
Glycogeen(n glucoseresiduen) + 3 ADP + 3 Pi → Glycogeen(n-1 glucoseresiduen) + 2 Lactaat + 3 ATP
In de lever wordt glucose-6-fosfaat uit glycogeen gedefosforyleerd door glucose-6-fosfatase (EC 3.1.3.9), en vervolgens in de bloedbaan vrijgegeven. Dit zijn de stappen in de verwijdering van glucose-eenheden, in de vorm van gefosforyleerde glucose, door de leverglycogenolyse:
Glycogeen(n glucoseresiduen) + Pi → Glucose-1-Fosfaat + Glycogeen(n-1 glucoseresiduen)
glucose-1-fosfaat → glucose-6-fosfaat
glucose-6-fosfaat + H2O → glucose + Pi
De globale vergelijking luidt:
Glycogeen(n glucoseresiduen) + H2O → Glycogeen(n-1 glucoseresiduen) +Gglucose
Covalente regulatie van glycogenolyse in spier en lever
Glycogeenafbraak staat onder een fijne controle door covalente en/of allosterische modificaties van enkele belangrijke eiwitten, zoals fosforylase kinase (EC 2.7.11.19), glycogeen fosforylase, en eiwit fosfatase 1.
Hier worden de effecten geanalyseerd van twee hormonen, die via covalente modificaties van doeleiwitten werken:
Deze hormonen, die zich aan hun membraanreceptoren binden, brengen een identieke cascade van intracellulaire gebeurtenissen op gang, die hun signaal met verscheidene orden van grootte versterken, waardoor de glycogenolyse wordt gestimuleerd en de glycogeensynthese wordt geremd.
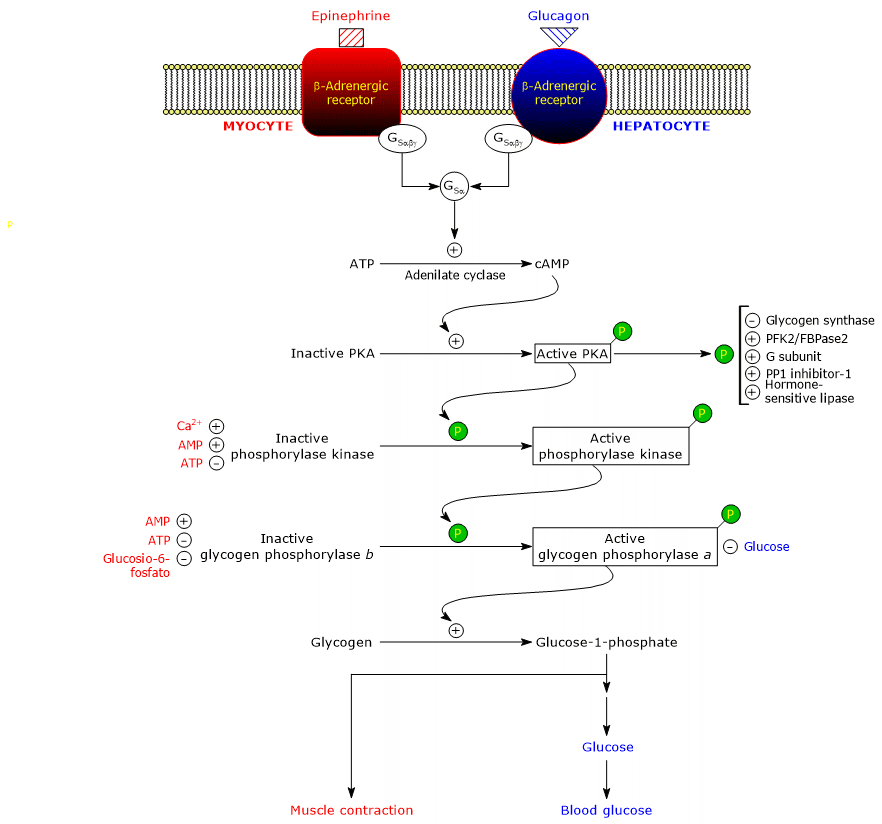
Het dient te worden opgemerkt dat zelfs acetylcholine, door binding aan de receptor bij de neuromusculaire junctie dezelfde cascade van activeringen van adrenaline en glucagon op gang brengt.
Hier volgen de eiwitten die bij de cascade betrokken zijn.
β-Adrenerge receptoren
De receptoren voor adrenaline en glucagon zijn integrale membraaneiwitten, met zeven transmembrane α-helften.
De term “adrenerge” is afgeleid van adrenaline. Er zijn vier subtypes van adrenerge receptoren: α1, α2, β1 en β2. In de verdere discussie zullen alleen β1 en β2 receptoren, aangeduid als β, die op dezelfde manier werken, worden beschouwd.
β-adrenerge receptoren veroorzaken veranderingen in het energiemetabolisme, zoals:
Stimulerende G-eiwitten
De binding van het hormoon aan de receptor veroorzaakt een conformatieverandering in het cytosolische deel van de receptor, en dit wijzigt de interactie met het tweede eiwit in de cascade: het stimulerende guanine nucleotide bindende eiwit of, eenvoudiger, stimulerend G-eiwit (GS). Het is een heterotrimeer dat bestaat uit drie subeenheden: α (dat de nucleotide bindingsplaats bevat), β, en γ. In de inactieve vorm, GSαβγ-GDP, is het heterotrimeer gekoppeld aan β-adrenerge receptoren.
De conformatieveranderingen in de receptor stellen deze in staat de vervanging van GDP door GTP in de α-subeenheid van het GSαβγ complex te katalyseren. Dit leidt tot dissociatie van het trimer in een inactief dimeer, βγ, en het GSα-GTP complex dat langs het vlak van het binnenoppervlak van de plasmamembraan beweegt, waaraan het is verankerd door een covalent verbonden palmitoylgroep, totdat het adenylyl cyclase (EC 4.6.1.1).
Notitie: de werking van GS lijkt op die van de Ras-eiwitten, een andere klasse G-eiwitten die betrokken zijn bij insulinesignaaltransductie.
Adenylcyclase
Het is een integraal membraaneiwit, waarvan de actieve site zich aan de cytosolische kant van het plasmamembraan bevindt. De interactie tussen GSα en adenyl cyclase activeert het enzym, dat op zijn beurt de synthese van cAMP uit ATP katalyseert. Dit leidt tot een verhoging van de intracellulaire concentratie van het cyclische nucleotide.
De stimulerende activiteit van GSα is zelfbegrenzend, omdat het een GPTasi is, dat wil zeggen, het hydrolyseert het gebonden GTP tot GDP, waardoor het zichzelf uitschakelt. In de inactieve vorm dissocieert GSα van adenyl cyclase en reassocieert weer met het Gβγ dimeer. Daardoor is het heterotrimeer weer beschikbaar voor interactie met een hormoon-receptorcomplex.
Proteïnekinase A
cAMP bindt en activeert cAMP-afhankelijk proteïnekinase of proteïnekinase A of PKA (EC 2.7.11.11). De inactieve vorm van het enzym is een tetramer die bestaat uit twee katalytische subeenheden en twee regulerende subeenheden. Elk van de twee regulerende subeenheden heeft een auto-inhibitorisch domein, d.w.z. een regio die de bindingsplaats voor het substraat van elke katalytische subeenheid bezet. De binding van twee cAMP-moleculen aan twee plaatsen op elke regulerende subeenheid leidt tot een conformatieverandering die hun dissociatie van het tetrameer veroorzaakt, waardoor de twee katalytische subeenheden als actieve enzymen vrijkomen. De actieve vorm van PKA katalyseert de fosforylering van sommige eiwitten, waardoor deze worden geactiveerd of geremd, zoals:
cAMP heeft een zeer korte halfwaardetijd: het wordt gehydrolyseerd tot AMP, dat geen tweede boodschapperactiviteit heeft, in de reactie die gekatalyseerd wordt door cyclisch nucleotide fosfodiësterase (EC 3.1.4.53). Cafeïne en theofylline, twee methylxanthines die respectievelijk in koffie en thee voorkomen, remmen het fosfodiësterase, waardoor de halfwaardetijd van cAMP toeneemt en de effecten ervan worden versterkt.
Fosforylase kinase
De volgende stap in de cascade wordt gekatalyseerd door fosforylase kinase.
Het eiwit is opgebouwd uit vier verschillende subeenheden, die elk met vier exemplaren aanwezig zijn om een complex te vormen dat (αβγδ)4 wordt genoemd. De γ subeenheden hebben katalytische activiteit, terwijl α, β en δ regulerende subeenheden zijn. α en β subeenheden worden gefosforyleerd wanneer het enzym overschakelt van de inactieve naar de actieve toestand. De δ-subeenheid, ook calmoduline genoemd, is een regulerend eiwit dat calciumionen bindt. Dit eiwit is ook aanwezig in een groot aantal andere enzymen. Het fungeert als calciumsensor, d.w.z. het reageert op veranderingen in de intracellulaire calciumconcentratie en beïnvloedt zo de activiteit van de eiwitten waarmee het interageert (zie hieronder). Fosforylase kinase bestaat in twee isovormen, één die tot expressie komt in de lever en de andere in skelet- en hartspieren; ze verschillen met betrekking tot de α en γ subeenheden, die worden gecodeerd door verschillende genen.
Eén van de doeleiwitten van het fosforylase kinase is glycogeen fosforylase. Dit enzym bestaat als isoenzymen in verschillende weefsels, en in twee conformatie toestanden in dynamisch evenwicht, aangeduid als:
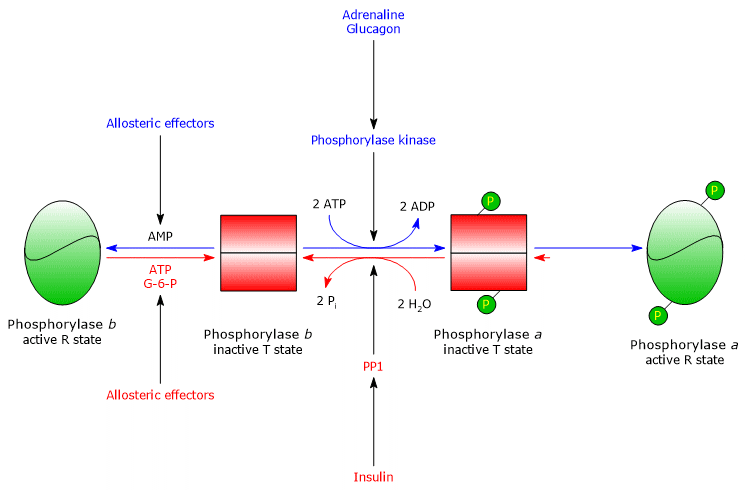
De kinase fosforyleert een enkel serine residu (Ser-14) in elk van de twee subeenheden van glycogeen fosforylase, dat bijna geheel in de T toestand is, en zet het om in de actieve vorm, die, omgekeerd, bijna geheel in de R toestand is, en daarom de afbraak van glycogeen in gang zet.
Het gefosforyleerde enzym is de actievere vorm van het enzym en wordt glycogeen fosforylase a genoemd; het niet gefosforyleerde enzym is de minder actieve vorm van het enzym, en wordt glycogeen fosforylase b genoemd. De twee enzymatische vormen kunnen allosterisch worden geremd of geactiveerd (zie hieronder).
In de spier komt bij glycogenolyse glucose 1-fosfaat vrij, dat, zoals eerder gezien, in de spier zelf wordt gemetaboliseerd om energie te produceren voor spiercontractie, en dus voor de vecht-of-vlucht reactie die door adrenaline wordt opgewekt.
In de lever zorgt glucagon voor de afgifte van glucose in de circulatie om hypoglykemie tegen te gaan.
Als de stressvolle situatie voorbij is, fosforylase a fosfatase, ook wel fosfoproteïnefosfatase 1 of PP1 genoemd (EC 3.1.3.17), katalyseert de verwijdering van fosfaatgroepen uit fosforylase kinase en glycogeen fosforylase a, waardoor ze worden omgezet in inactieve vormen (het enzym verwijdert ook de fosfaatgroepen uit glycogeen synthase). PP1 bestaat uit een katalytische subeenheid, die een lage katalytische efficiëntie en lage affiniteit voor glycogeen heeft, en de eerder genoemde G-subeenheid, die behoort tot een familie van eiwitten die andere eiwitten aan glycogeen binden, bekend als glycogeen-targeting eiwitten (ook fosforylase kinase, glycogeen fosforylase, en glycogeen synthase worden door eiwitten van deze familie aan glycogeendeeltjes gebonden).
PP1 wordt ook geremd door een ander eiwit, genaamd inhibitor 1 van PP1.
Zoals eerder gezien, fosforyleert PKA:
Dus brengt de binding van het hormoon aan zijn receptor een cascadereactie op gang die onder meer leidt tot de remming van de PP1-activiteit. Hierdoor blijven zowel glycogeenfosforylase als glycogeensynthase gefosforyleerd: het eerste enzym wordt geactiveerd, terwijl het laatste wordt geremd. Op deze wijze wordt het koolhydraatmetabolisme geoptimaliseerd.
Allosterische regulatie van glycogenolyse in spier en lever
Glycogenolyse wordt ook gereguleerd door zowel positieve als negatieve allosterische effectoren. Ze werken in op drie enzymen: spierfosforylase kinase, lever- en spierglycogeenfosforylase, en PP1.
Spierfosforylase kinase
De enzymactiviteit wordt gereguleerd door twee positieve allosterische effectoren, calciumion en AMP, en één negatieve allosterische effector, ATP.
Een stijging van de intracellulaire calciumionenconcentratie is het signaal voor spiercontractie en, eenmaal vrijgemaakt uit het sarcoplasmatisch reticulum, bindt calcium zich aan de δ-subeenheid (calmoduline) van het enzym, waardoor het wordt geactiveerd.
AMP hoopt zich op in de spier tijdens intense contractie, als gevolg van het verbruik van ATP, en bindt zich aan het enzym en activeert het. Omgekeerd, wanneer de ATP-concentratie hoog is, d.w.z. wanneer de spier niet samentrekt, bindt het aan de allosterische plaats voor AMP, waardoor het kinase wordt geïnactiveerd.
Fosforylase kinase in de lever
Sommige hormonen kunnen zowel covalente modificaties van doelwit-eiwitten teweegbrengen als het vrijkomen van calcium-ionen uit het endoplasmatisch reticulum veroorzaken.
In de lever wordt fosforylase kinase gereguleerd door hormonen die het vrijkomen van calcium-ionen veroorzaken. Voorbeelden zijn vasopressine, maar ook adrenaline wanneer het bindt aan de α1 receptoren. Wat adrenaline betreft, activeert de binding aan de α1-receptoren een G-eiwit dat fosfolipase C-β stimuleert, dat op zijn beurt fosfatidylinositol-4,5-bisfosfaat omzet in inositol-1,4,5-trifosfaat (IP3) en diacylglycerol. Inositol-1,4,5-trifosfaat veroorzaakt het vrijkomen van calciumionen uit het endoplasmatisch reticulum. Calciumionen, die zich binden aan de δ-subeenheid van fosforylase kinase, leiden tot de activering ervan.
Spierglycogeenfosforylase
Spierglycogeenfosforylase b wordt geactiveerd in aanwezigheid van hoge concentraties AMP, dat, bindend aan een specifieke nucleotidebindingsplaats, de quaternaire structuur van het enzym verandert, waardoor het allosterisch evenwicht verschuift in de richting van de actieve R-toestand van de b-vorm. Omgekeerd werken ATP en glucose-6-fosfaat, die met AMP concurreren om dezelfde nucleotide-bindingsplaats, als negatieve allosterische effecten, waardoor het allosterisch evenwicht verschuift naar de inactieve T toestand van de b vorm.
Spierglycogeenfosforylase a is actief, ongeacht de hoeveelheid AMP, ATP en glucose-6-fosfaat.
In rustende spieren is bijna al het glycogeenfosforylase in de inactieve b vorm.
In feite, zorgt de covalente en allosterische regulering van het enzym ervoor dat de intracellulaire glucosespiegels nauwkeurig worden gereguleerd.
Allosterische regulatie van PP1
PP1 wordt allosterisch geactiveerd door glucose-6-fosfaat, dus wanneer de cellulaire energielading laag is.
Hepatisch glycogeenfosforylase
In de lever verloopt de allosterische regulatie van het enzym via verschillende mechanismen.
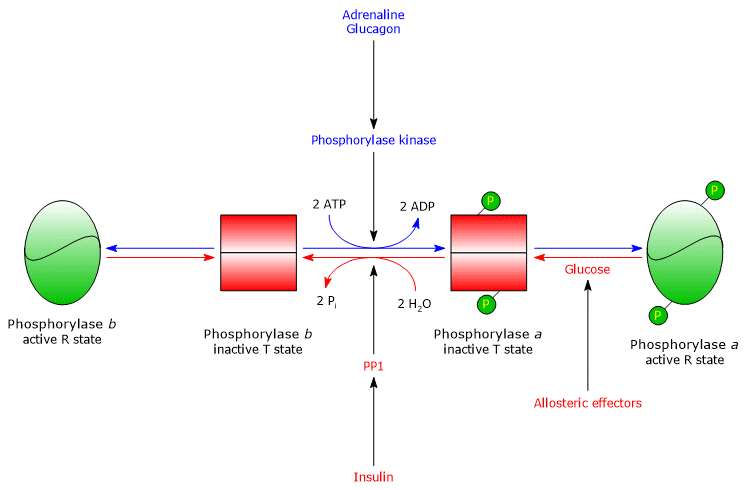
In de lever, is het doel van glycogenolyse om glucose aan andere weefsels te leveren wanneer het bloedglucosegehalte laag is. Wanneer de bloedglucosespiegel weer normaal is, stijgt de concentratie in de hepatocyten en bindt het zich aan glycogeenfosforylase a, waardoor een conformatieverandering optreedt die de gefosforyleerde serineresten blootstelt aan de activiteit van PP1, dat het enzym inactiveert door defosforylering. De allosterische plaats voor glucose van hepatisch glycogeen fosforylase stelt het enzym dus in staat om te fungeren als een bloedglucosesensor, die op gepaste wijze reageert op veranderingen in het bloedglucosegehalte. Uiteindelijk reageert het hepatische isoenzym alleen op glucose, niet op AMP, dat wil zeggen, op de cellulaire energielading, en dit is opmerkelijk omdat vetzuren, en niet glucose, de primaire energiebron voor de lever zijn.
Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5e editie. W. H. Freeman and Company, 2002
Nelson D.L., M. M. Cox M.M. Lehninger. Beginselen van de biochemie. 4e Ed. W.H. Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogeen en zijn metabolisme: enkele nieuwe ontwikkelingen en oude thema’s. Biochem J 2012:441;763-87. doi:10.1042/BJ20111416
Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., uitgave, 2009