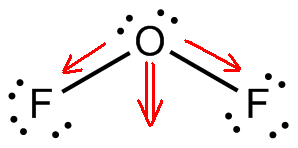
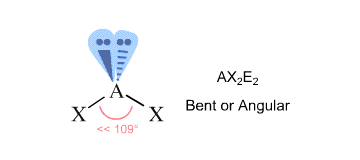Zuurstofdifluoride, #”OF”_2#, is een polair molecuul omdat het een gebogen molecuulgeometrie heeft.
Deze molecuulgeometrie zorgt ervoor dat de dipoolmomenten geassocieerd met de zuurstof – fluoridebindingen elkaar niet opheffen waardoor een niet-polair molecuul ontstaat.
Om te zien waarom dit het geval is, teken je de Lewisstructuur van het molecuul. Het molecuul heeft in totaal 20 valentie-elektronen
- #6# van het zuurstofatoom
- #7# van elk van de twee fluoratomen
Het zuurstofatoom neemt de rol van centraal atoom op zich en vormt enkele bindingen met de twee fluoratomen. Deze bindingen zijn goed voor #4# van de #20# valentie-elektronen van het molecuul.
De resulterende #16# elektronen worden als lone pairs geplaatst
- drie lone pairs op elk fluoratoom
- twee eenzame paren op het zuurstofatoom
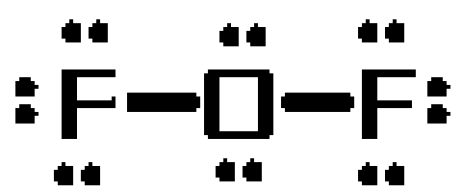
Nu, het is heel belangrijk om te beseffen dat de Lewis-structuren niet bedoeld zijn om de moleculaire geometrie over te brengen!
Om de geometrie van het molecuul te vinden, telt u de gebieden van elektronendichtheid die het centrale atoom omgeven – deze geven u het sterische getal van het atoom.
Regio’s van elektronendichtheid zijn bindingen met andere atomen (hier tellen enkele, dubbele of drievoudige bindingen als één regio) en eenzame elektronenparen.
In jouw geval, het centrale zuurstofatoom is gebonden aan twee andere atomen en wordt omgeven door twee lone pairs #-># heeft het een sterisch getal gelijk aan #4#.
Volgens de VSEPR-theorie komt dit overeen met een #”AX”_2 “E”_2# molecuulgeometrie, die karakteristiek is voor een gebogen molecuul.
Nu, het verschil in elektronegativiteit tussen fluor en zuurstof zorgt ervoor dat de twee #”O”-“F “# bindingen polair zijn. De gebogen moleculaire geometrie zal ervoor zorgen dat de twee dipoolmomenten bij elkaar opgeteld worden.
Het resultaat zal de vorming van een permanent dipoolmoment zijn, en dus een polair molecuul