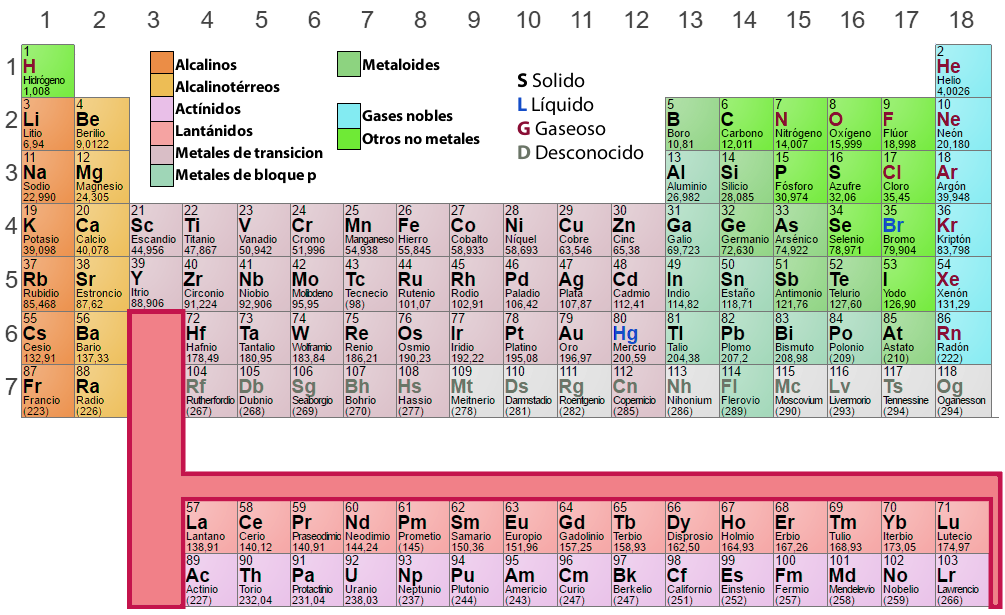
Het Periodiek Systeem is een tabel van de chemische elementen, gerangschikt naar atoomnummer, elektronische configuraties, en steeds terugkerende chemische eigenschappen. Deze volgorde laat periodieke tendensen zien, zoals elementen met vergelijkbaar gedrag in dezelfde kolom. In het algemeen staan binnen een rij (periode) de metalen links, en de niet-metalen rechts.
Het periodiek systeem is een van de meest emblematische symbolen van de wetenschap, het vat een groot deel van de kennis van de scheikunde samen. In al zijn versies is het aanwezig in klaslokalen en laboratoria over de hele wereld. Geen enkele andere discipline heeft een soortgelijk document.
Het periodiek systeem, ontwikkeld in de tweede helft van de 19e eeuw, voorzag in een systematische ordening van de elementen in natuurlijke groepen. Door de draagwijdte van deze opstelling konden de eigenschappen van enkele onbekende elementen en de waarschijnlijke verbindingen die zij vormden met vrij grote zekerheid worden voorspeld. Latere ontwikkelingen vormden de theoretische basis voor het huidige Periodiek Systeem. Het grote aantal bekende elementen en gesynthetiseerde stoffen creëerde een dringende behoefte om ze in te delen.
Een beetje geschiedenis over het Periodiek Systeem
In het begin van 1812 probeerde de Duitse scheikundige John W. Döbereiner een eerste benadering door de ontdekte elementen in groepen van drie te rangschikken. Bij deze classificatie werden de elementen gegroepeerd in oplopende volgorde volgens hun atoommassa.
In 1860 controleerde de Fransman Alexandre Béguyer (een Franse geoloog) een zekere periodiciteit in de elementen door hun afmetingen en fysische eigenschappen te vergelijken. In zijn studies verifieerde hij een logische volgorde tussen de grootheden en eigenschappen die in de atomen werden waargenomen en hun respectieve afmetingen en abundanties.
In 1864 publiceerde Julius Lothar Meyer de eerste versie van het periodiek systeem, en later de Russische scheikundige Dmitri Ivanovich Mendelejev die de Periodieke Wet en het Periodiek Systeem der Chemische Elementen uitvaardigde en publiceerde.

Dmitri Ivanovich Mendeleev
Mendeleevs voorspellende vermogen was briljant; Hij stelde niet alleen de wet van de chemische periodiciteit vast, maar rangschikte ook de gevonden elementen en bewaarde ruimte voor de elementen die nog niet ontdekt waren, en voorspelde zelfs hun fysische en chemische eigenschappen.
Het Periodiek Systeem Vandaag
Het gedrag van atomen wordt bepaald door hun elektronische configuratie, waarbij de verdeling van elektronen in het buitenste niveau hun reactiviteit en chemische aard bepaalt. Daarom zullen de elementen die een gelijksoortige elektronische verdeling bezitten, gelijksoortige chemische eigenschappen vertonen.
De eigenschappen van atomen keren periodiek terug als de chemische elementen worden gerangschikt volgens hun toenemend atoomnummer (Z).
Analyse van het periodiek systeem
In het periodiek systeem worden elementen die een vergelijkbaar patroon van elektronische configuratie in de buitenste schil hebben, in dezelfde kolommen (Groepen of Families) gerangschikt. De elementen die identieke energieniveaus hebben, zijn in dezelfde rijen (Perioden) gerangschikt.
Groepen of families
Dit is een verticale ordening van de elementen in het periodiek systeem, volgens vergelijkbare chemische eigenschappen. De traditionele nummering van de achttien kolommen is I A, II A, III A, IV A, enz, zoals we zien in het periodiek systeem hierboven. Tegenwoordig beveelt de IUPAC (International Union of Pure and Applied Chemistry) opeenvolgende nummering aan, d.w.z.: 1, 2, 3, 4, 5, enz. Het is belangrijk rekening te houden met het volgende:
- Waterstof (H), hoewel voorkomend in groep IA (1), is geen alkalimetaal. Integendeel, waterstof
is zo verschillend van de andere chemische elementen dat sommige indelingen het liever buiten de
tabel plaatsen. - Groepen A zijn de belangrijkste in de tabel, hun elementen worden representatief genoemd.
- Elementen in de groepen III B, IV B, V B, VI B, VII B, VIII B, I B en II B vormen de zogenaamde overgangs
elementen. Merk op dat groep VIII B een drievoudige groep is. - Een andere belangrijke scheiding die we in het periodiek systeem kunnen maken is die waarin we de
elementen verdelen in metalen, niet-metalen, en edelgassen.
Elementen in dezelfde groep bezitten vergelijkbare chemische eigenschappen en worden gekenmerkt door het hebben van een gelijk aantal elektronen in het laatste energieniveau. Elk element van een groep wordt in verschillende perioden geplaatst en om ze aan te duiden wordt met Romeinse cijfers (I, II, III, IV, enz.) het aantal elektronen in het laatste niveau genoteerd, gevolgd door een letter (A of B) die de aard ervan aangeeft en de soorten banen die het heeft.
Periodes
De zeven horizontale lijnen of rijen die in het periodiek systeem voorkomen worden periodes genoemd, het is belangrijk op te merken dat:
- In de zesde periode bevat het derde rooster 15 elementen (van lanthaan tot lutetium) die voor het gemak op een regel onder de tabel zijn aangegeven; beginnend met lanthaan vormen deze elementen de zogenaamde lanthanidereeks.
- Analoog omvat het derde rooster in de zevende periode ook 15 chemische elementen (actinium tot en met laurentium), die zijn aangegeven op de tweede regel onder de tabel. Beginnend met actinium vormen zij de actinidereeks.
- Opgemerkt zij dat alle elementen na uranium (U-92) niet in de natuur bestaan, maar kunstmatig moeten worden gesynthetiseerd. Ze worden transuranische elementen genoemd. Naast deze elementen worden ook technetium (Tc-43), promethium (Pm-61) en astatine (As-85) kunstmatig gesynthetiseerd.
Elementen van dezelfde periode hebben hetzelfde aantal energieniveaus met elektronen. De perioden zijn genummerd naar de waarde van het buitenste energieniveau. Elke periode begint met een alkalimetaal en eindigt met een edelgas, behalve het eerste niveau, waar zich waterstof bevindt.
Elementen in het Periodiek Systeem
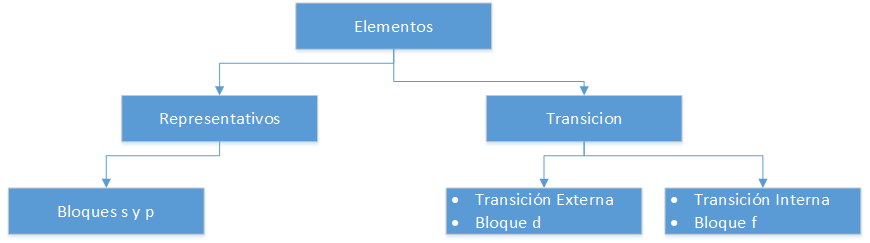
Representatieve Elementen
Zij komen overeen met groep A van het periodiek systeem. Zij voldoen niet aan de octet-regel, d.w.z. dat hun laatste energieniveau minder dan 8 elektronen bevat. Zo hebben de atomen van de representatieve elementen van groep III A, zoals Aluminium (Al), 3 valentie-elektronen in hun laatste schil, d.w.z. onvolledige p-banen (p1 t/m p6)
De elementen van de groepen IA t/m VA hebben de neiging elektronen op te geven om de dichtstbijzijnde edelgasconfiguratie (ns2 np6) te bereiken. Daarentegen vangen elementen uit de groepen VI A en VII A elektronen op om de dichtstbijzijnde edelgasconfiguratie te bereiken.
| Groep | Naam | Elektronische Configuratie |
|---|---|---|
| IA | Alkaline | ns1 |
| IIA | A. | ns2np2 |
| VA | Nitrogeen | ns2np3 |
| VIA | Calcogeen | ns2np4 |
| Calcogeen | ns2np4 | |
| VIIA | Halogenen | ns2np5 |
| 0 | Nobiele gassen | ns2np6 |
Externe overgangselementen
Zij zijn geplaatst in de groepen B van het periodiek systeem. De elementen die tot deze classificatie behoren, hebben d-banen (d1 tot d10) in hun laatste energieniveau.
Inner transition elements
Zij bevinden zich in het onderste deel van het periodiek systeem, ze worden ook wel zeldzame aarden genoemd. Hun belangrijkste kenmerk is dat zij f-banen (f1 tot f14) in hun laatste energieniveau hebben.
Natuur van de elementen
Noble gassen
- Kolom 18 in het periodiek systeem.
- Groep VIII of 0.
- Zij worden gekenmerkt door het feit dat al hun elektronische niveaus compleet zijn.
- Elektronische configuratie van het type ns2p6, ns2 (Helium).
- Onder normale omstandigheden zijn ze chemisch inert (zeer onreactief).
Metaalelementen
- Ze zijn bijna allemaal vast (bij kamertemperatuur), met uitzondering van Mercurius, Cesium en Rubidium.
- Zij geleiden zeer goed elektrische stroom.
- Zij verliezen gemakkelijk elektronen en worden stabiele kationen.
- Zij hebben een metaalglans en zijn zeer goede warmtegeleiders.
- Ze zijn kneedbaar, d.w.z. dat ze onder invloed van een kracht kunnen worden vervormd zonder te breken.
- Ze zijn kneedbaar, d.w.z. dat ze door hun vermogen tot vervorming kunnen worden gebruikt om platen te maken.