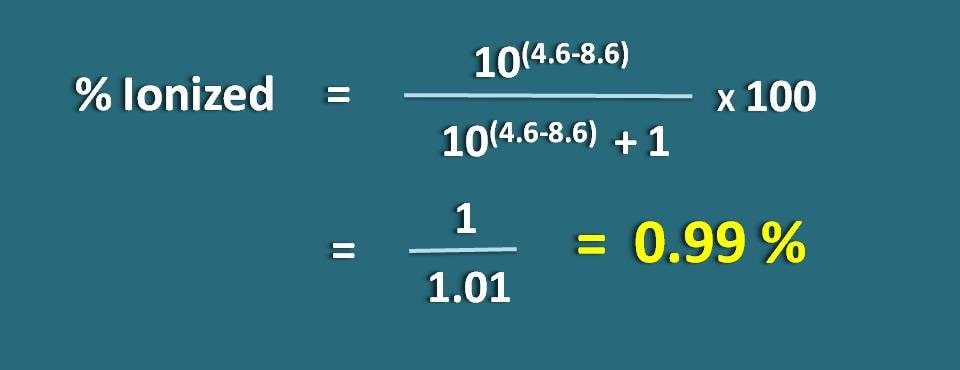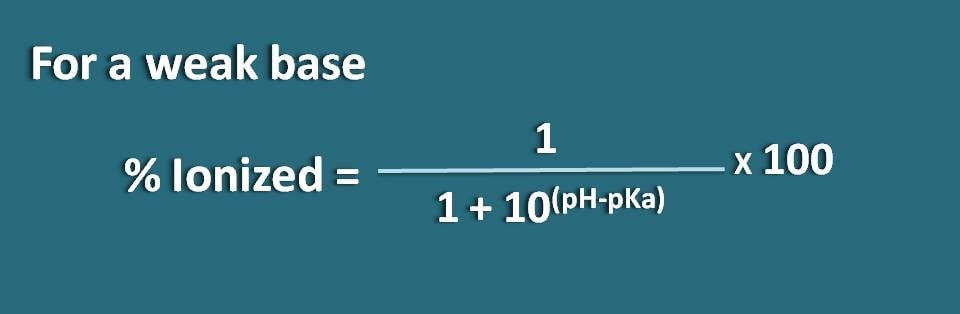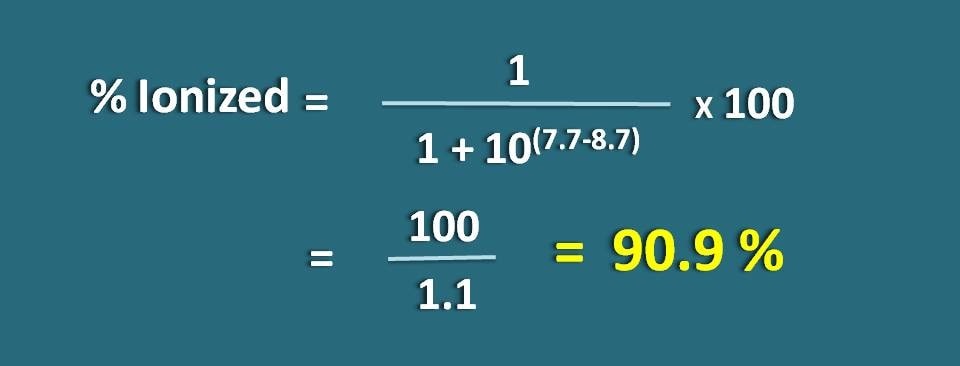Czasami potrzebujemy znać stan jonizacji związku organicznego, aby ocenić kilka właściwości fizykochemicznych tego związku. Na przykład, jeśli związek jest bardziej zjonizowany w danym pH, będzie miał większą rozpuszczalność w wodzie. Z drugiej strony, jeśli koncentrujemy się na przenikalności związku przez błonę fizjologiczną, to zunifikowana forma związku jest ważniejsza, ponieważ będzie bardziej lipofilna i może przekroczyć lipofilową błonę.
Więc obliczanie procentu jonizacji jest istotnym zadaniem, z którym spotykamy się wiele razy, gdy zajmujemy się farmakokinetyką leków. Zobaczmy, jak możemy go obliczyć wraz z kilkoma przykładami.
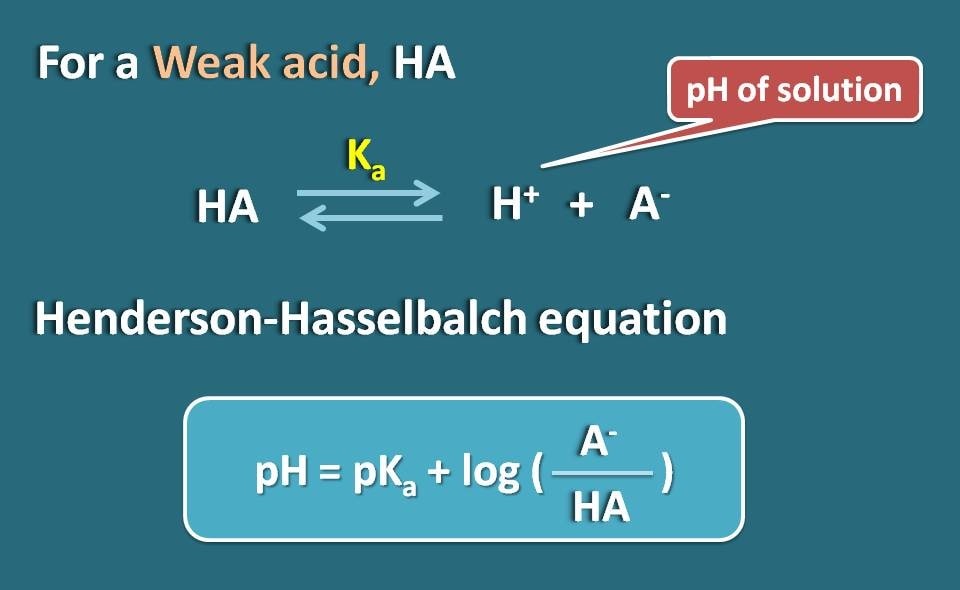
Równanie Hendersona-Hasselbalcha
Przyjmijmy słaby elektrolit, taki jak HA, który działa jak słaby kwas. Kiedy rozpuszcza się w wodzie, nie jest całkowicie zjonizowany, ale osiąga równowagę, dzięki czemu może istnieć zarówno w formie zjonizowanej, jak i zjonizowanej.
Zastosowując równanie Hendersena-Hasselbacha dla słabego kwasu, możemy powiązać pH roztworu z pKa leku i jego jonizacją.
Tak więc, pH=pKa + log(A-/HA)
Gdzie A- jest formą zjonizowaną słabego kwasu, podczas gdy HA jest formą zunifikowaną.
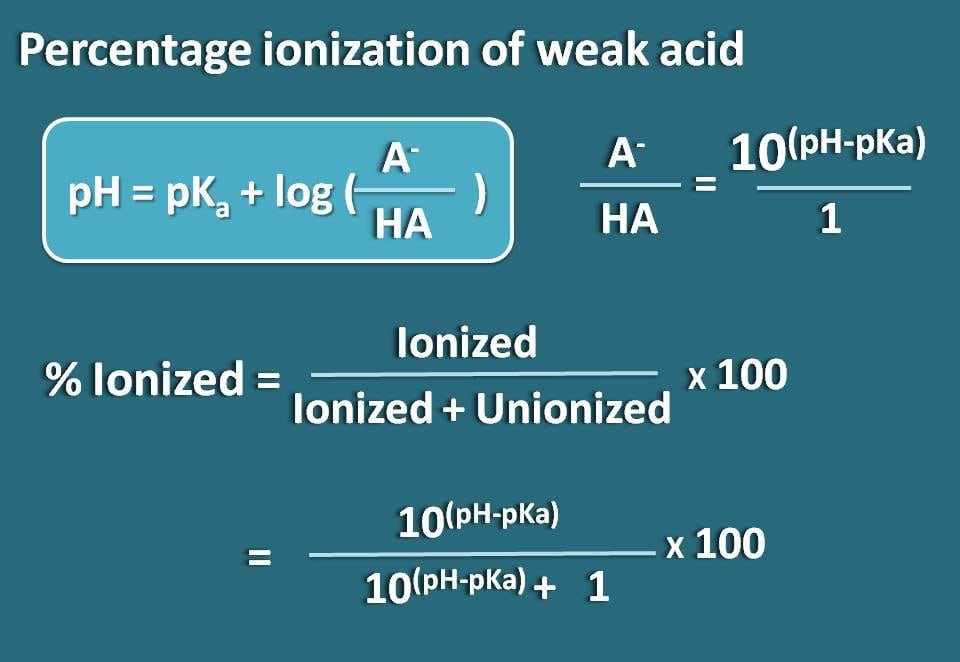
Przestudiujmy teraz to równanie tak, abyśmy otrzymali stosunek form zjonizowanych do zunifikowanych słabego kwasu.
log(A-/HA)=pH – pKa
Przykładając antylogarytm,
A-/HA=10(pH – pKa)
Teraz znamy stosunek formy zjonizowanej do formy zunifikowanej. Na tej podstawie możemy obliczyć procent jonizacji.
% zjonizowany= * 100
Substytuując w tym równaniu,
% zjonizowany=* 100
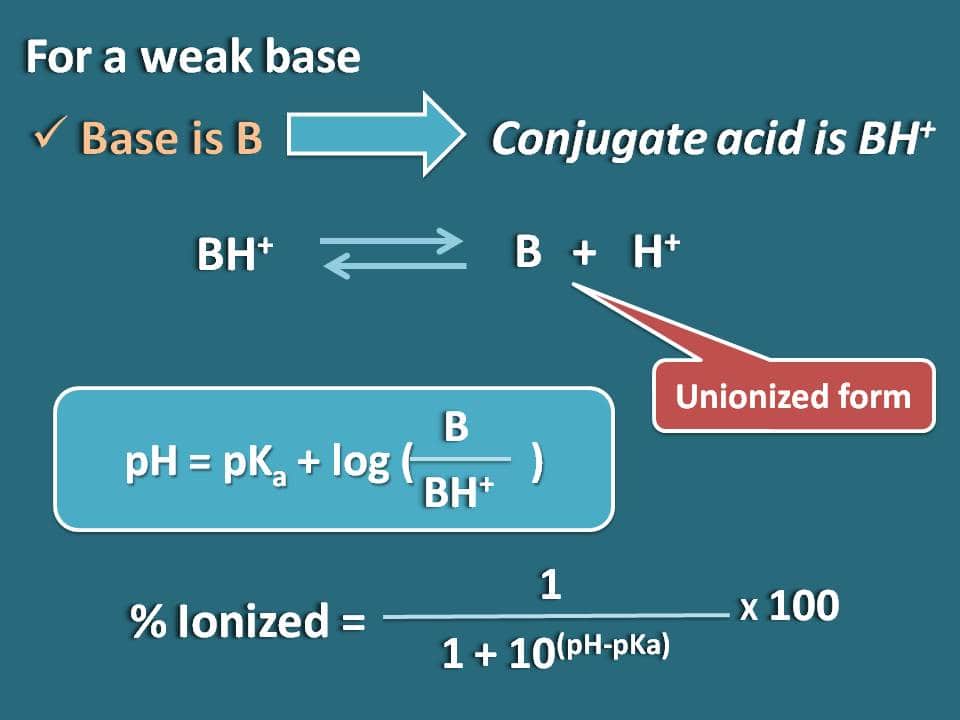
Podobnie możemy otrzymać wzór dla słabej zasady jak B, której sprzężonym kwasem jest BH+. Teraz możemy napisać równowagę chemiczną dla tego sprzężonego kwasu jak poniżej.
Teraz piszemy równanie Hendersena-Hasselbalcha dla kwasu sprzężonego
pH=pKa + log (B/BH+)
Teraz stosunek form zjednoczonych do zjonizowanych zasady można zapisać jako
B/BH+=10(pH – pKa)
Tutaj część formy zjednoczonej wynosi 10(pH – pKa), natomiast formy zjonizowanej 1. Zatem procent jonizacji wyniesie
% zjonizowany=* 100
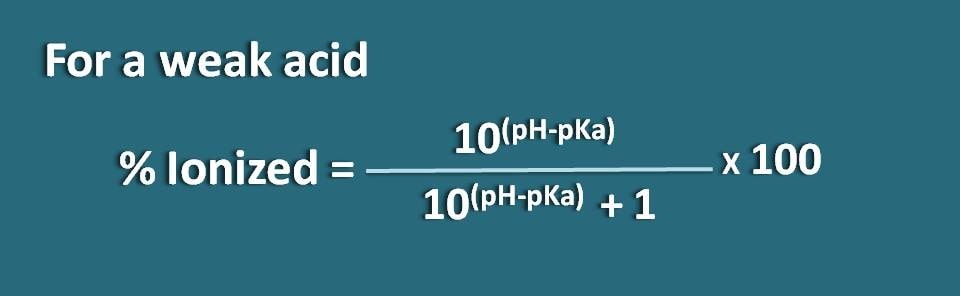
Alternatywnie, możemy również przekształcić powyższe równanie odwracając termin pH-pKa na pKa-pH, gdzie otrzymamy wzór jako
% zjonizowany=* 100
Teraz przejdźmy do kilku praktycznych przykładów i zobaczmy jak możemy je rozwiązać.
Przykład praktyczny 1
Oblicz procentową jonizację słabo kwaśnego leku przy pH 4,6 z wartością pKa jako 8,6.
Rozwiązanie:
Przede wszystkim wypiszmy podane dane.
PH=4,6 i pKa=8,6
Ponieważ jest to lek słabo kwaśny, zastosujmy następujący wzór.
Substytuując w powyższym równaniu,
% zjonizowany=* 100
=1/1,01=0.99 %
Przejdźmy do kolejnego przykładu.
Przykład praktyczny 2
Oblicz ułamek leku w postaci zjonizowanej przy pH 7.7 tkanki dla leku zasadowego o pKa 8,7.
Rozwiązanie:
Na początek wypiszmy podane dane.
pH=7.7 i PKa=8,7
W tym przypadku jest to słaba zasada, więc musimy zastosować następujący wzór.
Podając w powyższym równaniu,
% zjonizowany=* 100
=100/1.1=90,9 %
Na koniec podajemy inny przykład.
Przykład praktyczny 3
Oblicz stosunek protonowanych do nieprotonowanych form morfiny przy pH 5. pKa morfiny wynosi 7.
Rozwiązanie:
Ponownie podana data to pH=5 i pKa=7.
Morfina jest opioidowym lekiem przeciwbólowym, który posiada trzeciorzędową aminę w pierścieniu, stąd działa jako słaba zasada. Ale tutaj pytano o stosunek form protonowanych do nieprotonowanych leku. Forma protonowana to nic innego jak forma zjonizowana, natomiast forma nieprotonowana to forma zunifikowana. Dla słabej zasady stosunek ten będzie wynosił 10(pH – pKa) : 1.
i podstawmy wartości.
Protonowana/nieprotonowana=10(5 – 7)/1