El injerto, una antigua técnica agronómica, es un tipo de propagación vegetativa/asexual de las plantas. Suele llevarse a cabo aprovechando el crecimiento del callo después de una lesión en la planta. El injerto sigue siendo una técnica habitual en el campo de la jardinería. El injerto se ha utilizado en la agricultura desde > 2 000 años AEC (Antes de la Era Común) en China. Se utiliza ampliamente en la agricultura y el cultivo de árboles forestales y plantas hortícolas. Por ejemplo, los cultivares con resistencia a los patógenos o tolerancia al estrés se suelen utilizar como portainjertos para mejorar el vigor de crecimiento de los cultivares de superficie con alto valor económico. El injerto también se ha utilizado para romper la etapa juvenil con el fin de promover la floración en las especies leñosas. En comparación con los cultivos modificados genéticamente, las plantas injertadas son más agradables para el público. El injerto es también una técnica útil en la investigación científica de las plantas. En los años 70 y 80 del siglo pasado se realizaron esfuerzos considerables en este sentido. Sin embargo, con el rápido desarrollo de la biotecnología, el enfoque de la investigación sobre injertos se ha desplazado gradualmente desde la mejora de los rasgos agronómicos al estudio del mecanismo molecular. Los estudios han demostrado que el injerto es una excelente herramienta para dilucidar los mecanismos implicados en los procesos de señalización de largo alcance dentro de las plantas, como los que intervienen en la floración , la regulación de la auxina , la tolerancia a los metales pesados , el movimiento de pequeños ARN , el estado de nutrición y el silenciamiento nuclear .
Es bien sabido que los factores que afectan a las tasas de supervivencia del injerto dependen principalmente de la compatibilidad del patrón y la púa. La compatibilidad se refiere a la similitud entre el portainjerto y la púa con respecto a las características estructurales, genéticas y fisiológicas, y a la capacidad de adaptarse el uno al otro después del injerto. La compatibilidad de los injertos procedentes de las mismas plantas es la más fuerte; cuanto más lejos esté la relación entre las plantas, más débil será la compatibilidad entre ellas. Es difícil injertar plantas de diferentes géneros. Además de la compatibilidad de los injertos y los portainjertos, el vigor del portainjerto y de la púa es también un factor importante que afecta a la supervivencia del injerto. La tasa de supervivencia de las plantas injertadas también varía según la especie, y la tasa de supervivencia del cuerpo injertado es diferente incluso en la misma especie a diferentes edades. Además, los factores ambientales como la temperatura, la humedad y la intensidad de la luz también pueden afectar a la tasa de supervivencia de las plantas injertadas. En conclusión, hay muchos factores que influyen en la tasa de supervivencia de los injertos.
Arabidopsis thaliana y Eutrema salsugineum (Thellungiella salsuginea) pertenecen a la misma familia Cruciferae pero a géneros diferentes. La Arabidopsis thaliana se utiliza como planta modelo en los estudios genéticos de las dicotiledóneas. Eutrema Salsugineum (también conocida como berro de sal) es una excelente planta tolerante a la sal, y el genoma de E. salsugineum ha sido completado. Aproximadamente el 95% de los genes de E. salsugineum son similares a los que se expresan en Arabidopsis , y la mayoría de las secuencias de aminoácidos son las mismas que las de Arabidopsis . Eutrema salsugineum tiene un genoma nuclear relativamente pequeño, aproximadamente dos veces mayor que el de A. thaliana . Todos los ecotipos de E. salsugineum muestran resistencia a una serie de estreses ambientales como el frío, la sequía y el estrés oxidativo. E. salsugineum ha ganado atención debido a su extrema tolerancia a la sal. Por lo tanto, el berro de sal se sugirió como modelo de halófita para estudiar la tolerancia a la sal hace más de 20 años. Esto ha abierto una nueva ventana para la investigación que abarca una amplia gama de aspectos, incluyendo no sólo el estrés abiótico , sino también la fotosíntesis , la función de las proteínas relacionadas con el estrés , y la producción de cera superficial utilizando E. salsugineum como planta modelo. En Arabidopsis, se han desarrollado varios enfoques de injerto para investigar la señalización sistémica . Sin embargo, hasta donde sabemos, no hay ningún informe sobre métodos de injerto para E. salsugineum, o sobre métodos de injerto entre Arabidopsis y Eutrema. La dificultad del injerto entre estas plantas es significativamente alta. El éxito del injerto de estas dos plantas modelo ayudará a proporcionar conocimientos cruciales sobre los mecanismos moleculares que subyacen a la tolerancia al estrés de las plantas. Aquí demostramos dos métodos de microinjerto estéril para el injerto intergenérico entre Arabidopsis y Eutrema, con las ventajas de la simplicidad y la alta tasa de supervivencia.
Métodos de injerto
En el presente estudio, nos centramos en dos protocolos eficientes de microinjerto de plántulas estériles entre Arabidopsis, una planta sensible a la sal, y el berro de sal, una planta tolerante a la sal. Uno de los métodos fue el corte de la superficie plana del hipocótilo de las plántulas, como se describe por Seung y Turnbull et al. con algunas modificaciones. El otro método fue el injerto por corte, que demostraremos aquí. La abreviatura A/E utilizada aquí indica que las púas de A. thaliana se injertaron en cepas de E. salsugineum, y a la inversa, E/A indica que las púas de E. salsugineum se injertaron en cepas de A. thaliana. En un experimento de control, se realizaron autoinjertos de A. thaliana y E. salsugineum. Las plántulas autoinjertadas de A. thaliana se denominan A/A y las plántulas autoinjertadas de E. salsugineum se denominan E/E. Se aplicaron métodos de injerto optimizados a diferentes portainjertos y púas. El método de injerto de corte se utilizó para A/E (Fig. 1a) y el otro método, es decir, el corte de superficie plana de hipocótilo se utilizó para A/A, E/E y E/A (Fig. 1c, d). Es relativamente fácil lograr un injerto exitoso utilizando el método de injerto convencional (es decir, corte de superficie plana de hipocótilo-hipocótilo), y el crecimiento posterior de las plantas injertadas es generalmente satisfactorio. Por lo tanto, no discutiremos este método aquí.

Diagrama de la técnica de injerto. a, b Dos métodos diferentes de injerto de Arabidopsis thaliana injertada en Eutrema. Salsugineum (A/E), injerto de corte (a) y corte de superficie plana de hipocótilo (b). c E/A (E. salsugineum como vástago se injertó en A. thaliana como patrón. (d) Autoinjerto de E. salsugineum (E/E) y A. thaliana (A/A). La línea roja indica la posición del corte. Las puntas de flecha naranjas señalan la unión del injerto entre el tejido del brote y la raíz con el soporte de tubos de silicona (gris claro). Las flechas rojas en (a) denotan las partes de corte o eliminación. Las diferencias de color muestran las diferentes plantas, azul para E. salsugineum y verde para A. thaliana. Las raíces no se muestran aquí
Materiales y condiciones de crecimiento
Las semillas de A. thaliana Columbia-0 (Col) y de E. salsugineum (Shandong, China) utilizadas en este estudio se conservan y propagan en nuestro laboratorio. Las plantas se cultivaron en condiciones de luz de día largo (LD 16/8 h luz/oscuridad) o de día corto (SD 8/16 h luz/oscuridad), con ciclos día/noche de 22 °C/18 °C y 100 μmol m-2s-1 de intensidad lumínica.
Procedimiento de injerto
El protocolo paso a paso del método de injerto por corte aplicado para A/E fue el siguiente:
Preparación de los materiales de portainjerto y púa: las semillas de berro salado se desinfectaron con 0.5% de NaClO (clorhidrato de sodio) durante 6 minutos, seguido de 4-5 enjuagues en agua destilada, y posteriormente se sembraron en condiciones estériles en medio Murashige y Skoog (MS) de media potencia que contenía 1,0% de agar y 1% de azúcar. Una semana después del tratamiento de estratificación a baja temperatura (4 °C), las plántulas se transfirieron a condiciones SD y se cultivaron verticalmente con luz durante 10-15 días (o 7-10 días después de la germinación) como plántulas de portainjertos. Para la germinación de las semillas de Arabidopsis, el método de esterilización y las condiciones de crecimiento fueron las mismas que las de E. salsugineum, excepto el tratamiento de estratificación a baja temperatura (4 °C), que fue de 2-3 días. La edad óptima para injertar las plántulas de Arabidopsis es de 3-5 días. Dado que el tiempo de germinación y la tasa de crecimiento de las dos especies son diferentes, los tiempos de plantación se ajustaron en consecuencia. Por lo general, Arabidopsis debe plantarse después de la germinación de las semillas de berro salado.
-
Injerto en condiciones estériles (Fig. 1a): El procedimiento de injerto se realizó bajo microscopios anatómicos en una campana estéril. Las plántulas de E. salsugineum de tamaño uniforme se trasladaron con unas pinzas a un nuevo medio de agar MS al 1,0% de fuerza media. Para utilizarlas como portainjertos, se eliminaron las hojas verdaderas y los meristemos de las plántulas de E. salsugum con una cuchilla de doble filo de acero inoxidable, mientras que se conservaron los cotiledones. En las mismas condiciones de esterilidad, el hipocótilo de las plántulas de A. thaliana se cortó transversalmente a aproximadamente una cuarta parte de la altura desde la parte superior (normalmente 2-3 mm) y la parte superior de la plántula se utilizó como vástago. El corte de A. thaliana como vástago puede realizarse directamente en las placas del medio original o en las placas donde se ha preparado el berro de sal como portainjertos. La púa de A. thaliana se injertó en el berro salado sin ningún tipo de fijación, ya que la pequeña cantidad de líquido en las superficies de corte de las dos partes es suficiente para mantenerlas unidas. Después, la placa de Petri se selló rápida pero cuidadosamente con parafilm para preservar la humedad. Por favor, tenga la precaución de asegurarse de que las hojas se extienden de forma natural para evitar un posible desprendimiento debido al crecimiento de la planta.
Cultivo del cuerpo injertado: El complejo A/E injertado se colocó en condiciones de SD en una cabina de crecimiento Percival durante 6-8 días.
Transplante de plántulas injertadas (Fig. 2): De seis a ocho días después del injerto, se examinó la interfaz de unión a tope bajo un microscopio anatómico. En este momento, el injerto debe tener una conexión sólida entre la púa y la cepa. A continuación, las plántulas se trasladaron a un sistema hidropónico o a un suelo nutritivo según las necesidades. Después del trasplante, se debe prestar atención a cortar las raíces adventicias a tiempo, si se producen las raíces adventicias.
Fig. 2 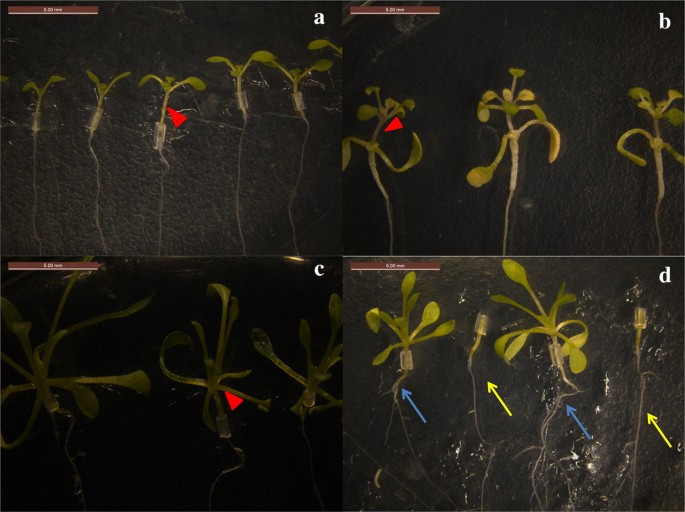
Semillas injertadas con éxito. a Autoinjerto de A. thaliana (A/A). b Semillas injertadas de A/E. c Autoinjerto de E. salsugineum (E/E). d Semillas injertadas de E/A. Las flechas rojas en a-c indican los lugares de injerto. Las raíces de Arabidopsis thaliana como portainjertos se muestran con flechas de diferentes colores en d, las flechas azules indican las raíces después del injerto, y las flechas amarillas indican las raíces antes del injerto
Desinfección de la superficie de las semillas
En el método de injerto por corte, la superficie de las semillas se desinfectó directamente utilizando 0.5% de clorhidrato de sodio (NaClO) durante 6-8 minutos, y luego se lavó con agua estéril durante 4-6 veces. Este método evita el uso de alcohol para la esterilización. Además, el método de esterilización con NaClO es sencillo, lo que reduce la contaminación secundaria, y las semillas pueden germinar normalmente. También evita la no germinación de las semillas por exceso de esterilización, que afecta a la germinación de las semillas y a los análisis posteriores. Siempre que se controle adecuadamente la concentración de NaClO, no se producirá una sobreesterilización aunque la esterilización dure varios minutos.
Edad de las plántulas
En el método de injerto por corte, las plántulas de E. salsugineum (7-10 días después de la brotación) con raíces laterales, pueden cumplir mejor con las características de crecimiento rápido de sus injertos (A. thaliana), esto también reduce la formación de raíces adventicias, mejora en gran medida la tasa de supervivencia de los injertos y asegura el crecimiento vigoroso de las plántulas injertadas en la etapa posterior (Tabla 1). Encontramos que las plántulas de Arabidopsis de 3-5 días de edad eran favorables para mejorar la tasa de supervivencia de las plántulas injertadas; también apoya el crecimiento vigoroso de las plántulas injertadas (Tabla 1). Esto puede deberse a que el ciclo de vida de A. thaliana es corto, en comparación con el de E. salsugineum. Por lo tanto, el uso de plántulas más viejas de A. thaliana como injertos resultó en bajas tasas de supervivencia; incluso si los injertos de A/E sobrevivieron, el crecimiento en etapas posteriores fue pobre y generalmente se observa una floración temprana.
Tabla 1 Variación de la edad de las plántulas en los injertos de A/E Método de corte en superficie plana
Se han reportado múltiples tipos de métodos de injerto para A. thaliana . En el presente estudio, el método de injerto de corte sólo se utilizó para injertos A/E y el método de corte de superficie plana de hipocótilo se utilizó para A/A, E/E y E/A (Fig. 1c, d). Los dos métodos requieren las mismas condiciones de cultivo, excepto el lugar de corte. Para el autoinjerto A/A se utilizaron plántulas de 3-5 días de edad. Para el injerto E/A, las plántulas de 7 a 10 días de A. thaliana como portainjertos son más beneficiosas para la supervivencia de los injertos. Del mismo modo, se utilizaron plántulas de 7 a 10 días de edad para el autoinjerto E/E. Encontramos que tanto la tasa de supervivencia como el crecimiento posterior de las plántulas de A/E fueron significativamente diferentes entre los dos métodos de injerto (Fig. 1a, b y Tabla 2). El método de corte es más satisfactorio para el injerto de A/E. La razón principal podría ser que la rápida tasa de crecimiento de A. thaliana se acomoda mejor utilizando este método. Cuando se utilizó el corte tradicional de superficie plana para el injerto A/E, las raíces adventicias de la púa aparecen antes de la formación del callo en la unión, lo que afecta a la tasa de éxito de las plantas injertadas, ya que el crecimiento del berro salado es más lento que el de A. thaliana. En comparación, la tasa de éxito del método de corte es casi del 100% siempre que el corte sea suave y las dos partes estén bien colocadas.
Tabla 2 Efectos de los dos métodos de injerto en el injerto de A/E
