L’innesto, una vecchia tecnica agronomica, è un tipo di propagazione vegetativa/asessuale delle piante. Di solito viene effettuato sfruttando la crescita del callo dopo una lesione della pianta. L’innesto è ancora una tecnica comune nel campo del giardinaggio. L’innesto è stato usato in agricoltura fin da > 2 000 anni BCE (Before the Common Era) in Cina. È ampiamente utilizzato in agricoltura e nella coltivazione di alberi forestali e piante orticole. Per esempio, le cultivar con resistenza ai patogeni o tolleranza allo stress sono solitamente usate come portinnesti per migliorare il vigore di crescita delle cultivar fuori terra con alti valori economici. L’innesto è stato anche usato per rompere lo stadio giovanile al fine di promuovere la fioritura nelle specie legnose. Rispetto alle colture geneticamente modificate, le piante innestate sono più appetibili per il pubblico. L’innesto è anche una tecnica utile nella ricerca scientifica sulle piante. Notevoli sforzi in questa direzione sono iniziati negli anni 70 e 80 del secolo scorso. Tuttavia, con il rapido sviluppo della biotecnologia, l’attenzione della ricerca sull’innesto si è gradualmente spostata dal miglioramento dei tratti agronomici allo studio del meccanismo molecolare. Gli studi hanno dimostrato che l’innesto è uno strumento eccellente per chiarire i meccanismi coinvolti nei processi di segnalazione a lungo raggio all’interno delle piante, come quelli coinvolti nella fioritura, nella regolazione dell’auxina, nella tolleranza ai metalli pesanti, nel movimento di piccoli RNA, nello stato di nutrizione e nel silenziamento nucleare. La compatibilità si riferisce alla somiglianza tra il portainnesto e la marza per quanto riguarda le caratteristiche strutturali, genetiche e fisiologiche, e la capacità di adattamento reciproco dopo l’innesto. La compatibilità degli innesti dalle stesse piante è la più forte; più lontano è il rapporto tra le piante, più debole è la compatibilità tra loro. È difficile innestare piante di generi diversi. Oltre alla compatibilità delle marze e dei portainnesti, anche il vigore del portainnesto e della marza è un fattore importante che influenza la sopravvivenza dell’innesto. Il tasso di sopravvivenza delle piante innestate varia anche con le specie, e il tasso di sopravvivenza del corpo innestato è diverso anche nella stessa specie a diverse età. Inoltre, anche i fattori ambientali come la temperatura, l’umidità e l’intensità della luce possono influenzare il tasso di sopravvivenza delle piante innestate. In conclusione, ci sono molti fattori che influenzano il tasso di sopravvivenza degli innesti.
Arabidopsis thaliana e Eutrema salsugineum (Thellungiella salsuginea) appartengono alla stessa famiglia Cruciferae ma a generi diversi. Arabidopsis thaliana è usata come pianta modello negli studi genetici sulle piante dicotiledoni. L’Eutrema Salsugineum (aka. Salt cress) è un’eccellente pianta tollerante al sale, e il genoma di E. salsugineum è stato completato. Circa il 95% dei geni dell’E. salsugineum sono simili a quelli espressi nell’Arabidopsis, e la maggior parte delle sequenze di aminoacidi sono le stesse di quelle dell’Arabidopsis. Eutrema salsugineum ha un genoma nucleare relativamente piccolo, circa due volte quello di A. thaliana. Tutti gli ecotipi di E. salsugineum mostrano resistenza ad una serie di stress ambientali come il freddo, la siccità e gli stress ossidativi. E. salsugineum ha guadagnato l’attenzione grazie alla sua estrema tolleranza al sale. Pertanto, il crescione salato è stato proposto come alofita modello per lo studio della tolleranza al sale più di 20 anni fa. Questo ha aperto una nuova finestra per la ricerca che copre una vasta gamma di aspetti, tra cui non solo lo stress abiotico, ma anche la fotosintesi, la funzione proteica legata allo stress e la produzione di cera superficiale utilizzando E. salsugineum come pianta modello. In Arabidopsis, diversi approcci di innesto sono stati sviluppati per studiare la segnalazione sistemica. Tuttavia, per quanto ne sappiamo, non ci sono relazioni sui metodi di innesto per E. salsugineum, o sui metodi di innesto tra Arabidopsis ed Eutrema. La difficoltà di innesto tra queste piante è significativamente alta. Il successo dell’innesto di queste due piante modello aiuterà a fornire intuizioni cruciali sui meccanismi molecolari alla base della tolleranza allo stress delle piante. Qui dimostriamo due metodi di micro-innesto sterile per l’innesto inter-generico tra Arabidopsis ed Eutrema, con i vantaggi della semplicità e dell’alto tasso di sopravvivenza.
Metodi d’innesto
Nel presente studio, ci concentriamo su due efficienti protocolli di micro-innesto sterile di piantine tra Arabidopsis, una pianta sensibile al sale, e crescione salino, una pianta tollerante al sale. Un metodo era il taglio ipocotile-ipocotile a superficie piatta delle piantine, come descritto da Seung e Turnbull et al. con alcune modifiche. L’altro metodo era l’innesto cut-in, che dimostreremo qui. L’abbreviazione A/E usata qui indica che le marze di A. thaliana sono state innestate su stock di E. salsugineum, e viceversa E/A indica che le marze di E. salsugineum sono state innestate su stock di A. thaliana. In un esperimento di controllo, l’auto-innesto di A. thaliana e E. salsugineum è stato eseguito. Le piantine autoinnestate di A. thaliana sono denominate A/A e le piantine autoinnestate di E. salsugineum sono denominate E/E. I metodi d’innesto ottimizzati sono stati applicati a diversi portinnesti e marze. Il metodo di innesto cut-in è stato utilizzato per A/E (Fig. 1a) e l’altro metodo, cioè il taglio ipocotile-ipocotile a superficie piatta è stato utilizzato per A/A, E/E, ed E/A (Fig. 1c, d). È relativamente facile ottenere un innesto di successo usando il metodo d’innesto convenzionale (cioè, taglio ipocotile-ipocotile a superficie piana), e la crescita successiva delle piante innestate è solitamente soddisfacente. Pertanto, non discuteremo questo metodo in questa sede.

Diagramma della tecnica di innesto. a, b Due diversi metodi di innesto di Arabidopsis thaliana innestata su Eutrema. Salsugineum (A/E), innesto cut-in (a) e taglio ipocotile-ipocotile a superficie piana (b). c E/A (E. salsugineum come marze sono state innestate su A. thaliana come stock. (d) Auto-innesto di E. salsugineum (E/E) e A. thaliana (A/A). La linea rossa indica la posizione di taglio. Le frecce arancioni indicano la giunzione d’innesto tra il tessuto del germoglio e della radice con il supporto del tubo di silicone (grigio chiaro). Le frecce rosse in (a) indicano le parti di taglio o di rimozione. Le differenze di colore mostrano piante diverse, blu per E. salsugineum e verde per A. thaliana. Le radici non sono mostrate qui
Materiali e condizioni di crescita
I semi di Arabidopsis thaliana Columbia-0 (Col) e i semi di E. salsugineum (Shandong, Cina) usati in questo studio sono conservati e propagati nel nostro laboratorio. Le piante sono state coltivate in condizioni di luce di lunga giornata (LD 16/8 ore luce/buio) o di breve giornata (SD 8/16 ore luce/buio), con cicli giorno/notte di 22 °C/18 °C e intensità luminosa di 100 μmol m-2s-1.
Procedura d’innesto
Il protocollo passo per passo del metodo d’innesto cut-in applicato per A/E è stato il seguente:
Preparazione dei materiali portinnesto e marza: i semi di crescione salato sono stati disinfettati con 0.5% NaClO (cloridrato di sodio) per 6 minuti seguito da 4-5 risciacqui in acqua distillata, e successivamente seminato in condizioni sterili su mezzo Murashige e Skoog (MS) contenente 1,0% di agar e 1% di zucchero. Una settimana dopo il trattamento di stratificazione a bassa temperatura (4 °C), le piantine sono state trasferite in condizioni SD e coltivate verticalmente con la luce per 10-15 giorni (o 7-10 giorni dopo la germinazione) come piantine portinnesto. Per la germinazione dei semi di Arabidopsis, il metodo di sterilizzazione e le condizioni di crescita erano le stesse di quelle di E. salsugineum, tranne il trattamento di stratificazione a bassa temperatura (4 °C), che era per 2-3 giorni. L’età ottimale per l’innesto delle piantine di Arabidopsis è di 3-5 giorni. Poiché il tempo di germinazione e il tasso di crescita delle due specie sono diversi, i tempi di impianto sono stati regolati di conseguenza. Di solito l’Arabidopsis dovrebbe essere piantata dopo la germinazione dei semi di crescione salato.
-
Innestare in condizioni sterili (Fig. 1a): La procedura d’innesto è stata eseguita sotto microscopi anatomici in una cappa sterile. Piantine di E. salsugineum di dimensioni uniformi sono state spostate con delle pinzette su un nuovo terreno MS agar all’1,0% a metà forza. Per essere usati come portainnesti, le foglie vere e i meristemi sono stati rimossi dalle piantine di crescione salato con un rasoio a doppia lama in acciaio inossidabile, mentre i cotiledoni sono stati conservati. Nelle stesse condizioni sterili, l’ipocotile delle piantine di A. thaliana è stato tagliato trasversalmente a circa un quarto dell’altezza dalla cima (tipicamente 2-3 mm) e la parte superiore della piantina è stata usata come talea. Il taglio di A. thaliana come talea può essere effettuato direttamente nelle piastre del terreno originale o nelle piastre dove il crescione salato è stato preparato come portainnesto. La marza di A. thaliana è stata innestata sul crescione salato senza alcun fissaggio perché la piccola quantità di liquido sulle superfici di taglio delle due parti è sufficiente a tenerle insieme. In seguito, la capsula Petri è stata rapidamente ma accuratamente sigillata con parafilm per preservare l’umidità. Si prega di fare attenzione ad assicurarsi che le foglie siano naturalmente estese per evitare possibili slittamenti dovuti alla crescita delle piante.
-
Coltivazione del corpo innestato: Il complesso A/E innestato è stato posto in condizioni SD in un armadio di crescita Percival per 6-8 giorni.
-
Trapianto delle piantine innestate (Fig. 2): Da sei a otto giorni dopo l’innesto, l’interfaccia del giunto di testa è stata esaminata al microscopio anatomico. A questo punto, l’innesto riuscito dovrebbe avere una solida connessione tra la marza e il ceppo. Le piantine sono state poi trasferite in un sistema idroponico o in un terreno nutriente secondo le esigenze. Dopo il trapianto, si dovrebbe prestare attenzione a tagliare le radici avventizie in tempo, se le radici avventizie si presentano.
Fig. 2 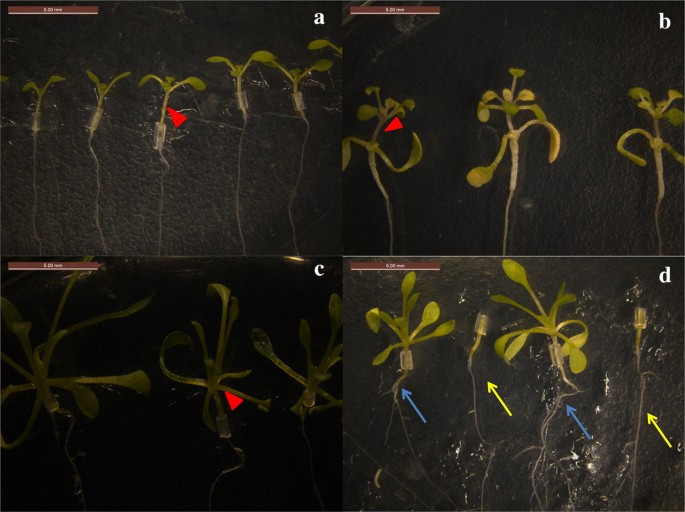
Successo delle piantine innestate. a Auto-innesto di A. thaliana (A/A). b Piantine innestate A/E. c Auto-innesto di E. salsugineum (E/E). d Piantine innestate E/A. Le frecce rosse in a-c indicano i siti d’innesto. Le radici di Arabidopsis thaliana come portainnesti sono indicate da frecce di diversi colori in d, le frecce blu indicano le radici dopo l’innesto, e le frecce gialle indicano le radici prima dell’innesto
Disinfezione della superficie dei semi
Nel metodo di innesto cut-in, la superficie dei semi è stata disinfettata direttamente con lo 0.5% di cloruro di sodio (NaClO) per 6-8 minuti, e poi lavata con acqua sterile per 4-6 volte. Questo metodo evita l’uso di alcool per la sterilizzazione. Inoltre, il metodo di sterilizzazione con NaClO è semplice, riducendo così l’inquinamento secondario, e i semi possono germinare normalmente. Evita anche la mancata germinazione dei semi a causa di una sterilizzazione eccessiva, che influisce sulla germinazione dei semi e sulle analisi successive. Finché la concentrazione di NaClO è controllata correttamente, la sovrasterilizzazione non si verifica anche se la sterilizzazione dura diversi minuti.
Età delle piantine
Nel metodo d’innesto cut-in, le piantine di E. salsugineum (7-10 giorni dopo il germogliamento) con radici laterali, può soddisfare meglio le caratteristiche di crescita rapida delle loro marze (A. thaliana), questo riduce anche la formazione di radici avventizie, migliora notevolmente il tasso di sopravvivenza degli innesti e garantisce la crescita vigorosa delle piantine innestate nella fase successiva (Tabella 1). Abbiamo trovato che le piantine di 3-5 giorni di Arabidopsis erano favorevoli a migliorare il tasso di sopravvivenza delle piantine innestate; supporta anche la crescita vigorosa delle piantine innestate (Tabella 1). Questo può essere dovuto al fatto che il ciclo di vita di A. thaliana è breve, rispetto a quello di E. salsugineum. Pertanto, l’uso di vecchie piantine di A. thaliana come marze ha portato a bassi tassi di sopravvivenza; anche se gli innesti A/E sono sopravvissuti, la crescita nelle fasi successive è stata scarsa e la fioritura precoce è solitamente osservata.
Metodo di taglio a superficie piana
Sono stati riportati molteplici tipi di metodi di innesto per A. thaliana . Nel presente studio, il metodo di innesto cut-in è stato utilizzato solo per gli innesti A/E e il metodo di taglio ipocotile-ipocotile a superficie piana è stato utilizzato per A/A, E/E, ed E/A (Fig. 1c, d). I due metodi richiedono le stesse condizioni di coltura tranne che per il sito di taglio. Piantine di 3-5 giorni sono state usate per l’autoinnesto A/A. Per l’innesto E/A, le piantine di A. thaliana di 7-10 giorni come portinnesti sono più vantaggiose per la sopravvivenza degli innesti. Allo stesso modo, piantine di 7-10 giorni sono state utilizzate per gli autoinnesti E/E. Abbiamo trovato che sia il tasso di sopravvivenza che la crescita successiva delle piantine di A/E erano significativamente diverse tra i due metodi di innesto (Fig. 1a, b e Tabella 2). Il metodo cut-in è più soddisfacente per l’innesto di A/E. La ragione principale potrebbe essere il tasso di crescita veloce di A. thaliana che si adatta meglio a questo metodo. Quando il taglio tradizionale a superficie piana è stato usato per l’innesto A/E, le radici avventizie della marza appaiono prima della formazione del callo alla giunzione, influenzando la percentuale di successo delle piante innestate, perché la crescita del crescione salato è più lenta di quella di A. thaliana. In confronto, la percentuale di successo del metodo di innesto a taglio è quasi del 100%, purché il taglio sia liscio e le due parti siano ben posizionate.
