
Definitie
Wanneer twee verschillende metalen of legeringen worden ondergedompeld in een corrosieve oplossing of regelmatig door vocht met elkaar worden verbonden, zal elk een corrosiepotentiaal ontwikkelen. Als de voorwaarden voor galvanische corrosie aanwezig zijn, zal het edelere metaal de kathode worden en het actievere metaal de anode. Er kan een meetbare stroom vloeien tussen de anode en de kathode. Indien dit gebeurt, zal de corrosiesnelheid van de anode in het bedrijfsmilieu toenemen, terwijl de corrosiesnelheid van de kathode zal afnemen. De verhoogde corrosie van de anode wordt “galvanische corrosie” genoemd.
Galvanische corrosie wordt soms gebruikt om de levensduur van materialen te verlengen (b.v. zinkcoatings op koolstofstaal en zinkanodes in boilers), maar als er geen rekening mee wordt gehouden en de juiste omstandigheden aanwezig zijn, kan het tot onverwachte storingen leiden.
Eisen voor galvanische corrosie:
Om galvanische corrosie te laten optreden, zijn drie elementen nodig.
- Twee metalen met verschillende corrosiepotentialen
- Direct metaal-op-metaal elektrisch contact
- Een geleidende elektrolytoplossing (b.v. water) moet de twee metalen regelmatig met elkaar verbinden. De elektrolytoplossing creëert een “geleidende weg”. Dit kan gebeuren bij regelmatige onderdompeling, condensatie, regen, mistblootstelling of andere vochtbronnen die de twee metalen bevochtigen en met elkaar verbinden.
Als een van deze elementen ontbreekt, kan galvanische corrosie niet optreden. Als bijvoorbeeld het directe contact tussen de twee metalen wordt verhinderd (plastic beschermlaag, verflaag, enz.) of als er een andere onderbreking is in het geleidende pad, kan er geen galvanische corrosie optreden en zal elk metaal corroderen met zijn normale snelheid in die service-omgeving. Figuur 1 toont voorbeelden van omstandigheden die niet aan alle vereisten voor galvanische corrosie voldoen.
Figuur 1
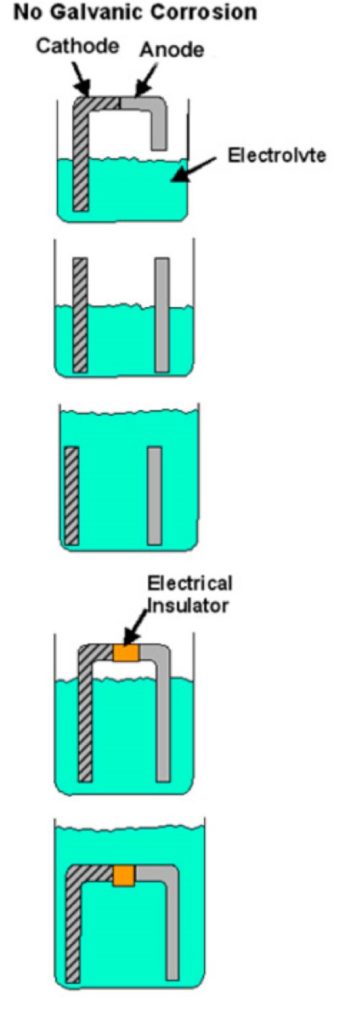
Voorbeelden van bi-metaalcombinaties waarbij geen galvanische corrosie kan optreden
Wanneer twee verschillende metalen in de atmosfeer of in water aan elkaar worden gekoppeld, kan de kans op het ontstaan van galvanische corrosie worden voorspeld met behulp van een “galvanische reeks.” Bij gespecialiseerde toepassingen, zoals wanneer ongelijke metalen in beton worden ingebed, moeten corrosiegegevens voor dat specifieke milieu worden gebruikt.
Figuur 2
Figuur 2 toont de galvanische reeks gemeten in zeewater voor enkele veel voorkomende metalen en legeringen. Wanneer twee metalen verder uit elkaar in de lijst staan (bijvoorbeeld een groter verschil tussen de twee getallen), wordt de drijvende kracht voor galvanische corrosie groter. De meest anodische (actieve) metalen staan bovenaan en de meest kathodische (edele) onderaan. Zowel massieve als holle staven worden getoond voor de roestvaste staalsoorten. De holle staven stellen actief corroderend roestvast staal voor, dat een ander potentiaal heeft dan passief (niet corroderend) roestvast staal. In de meeste toepassingen, waar ongelijksoortige metalen worden gecombineerd, moet de passieve (massieve) staaf worden gebruikt om de positie van het roestvast staal te bepalen.
Bij voorbeeld, als zink (denk aan gegalvaniseerd staal) dat een actief materiaal is en bovenaan de lijst staat en roestvast staal, een edel metaal en onderaan de lijst, in direct contact zouden staan en in aanwezigheid van een elektrolyt (water), zal galvanische corrosie optreden als zij regelmatig aan een elektrolyt worden blootgesteld.
