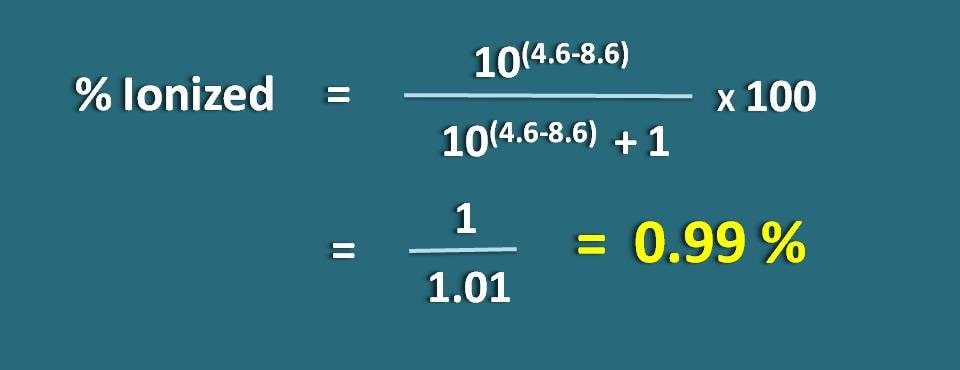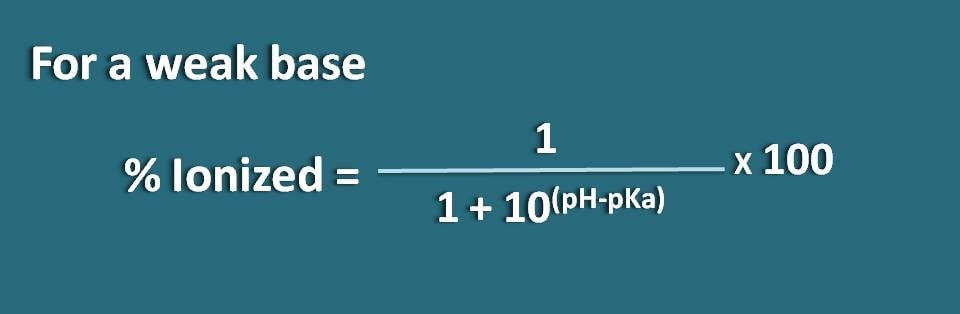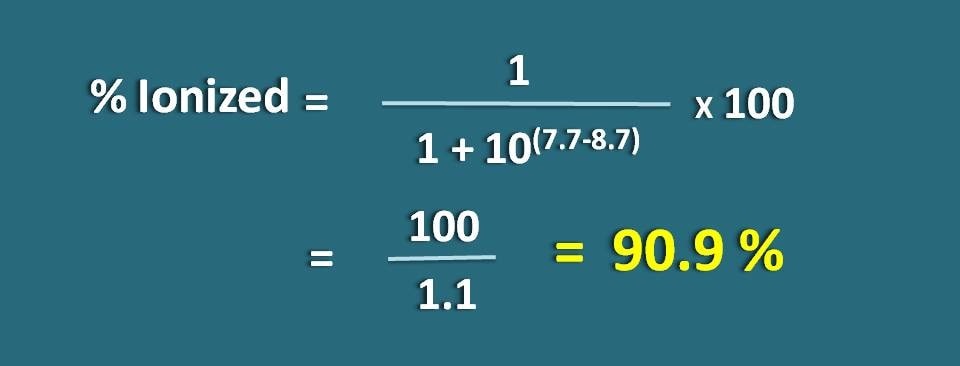A volte abbiamo bisogno di conoscere lo stato di ionizzazione di un composto organico per valutare alcune proprietà fisico-chimiche del composto. Per esempio, se il composto è più ionizzato a un determinato pH, avrà più solubilità in acqua. D’altra parte, se ci concentriamo sulla permeabilità del composto attraverso una membrana fisiologica, allora la forma unionizzata del composto è più importante in quanto sarà più lipofila e può attraversare la membrana lipofila.
Quindi, il calcolo della ionizzazione percentuale è un compito essenziale che incontriamo molte volte mentre ci occupiamo di farmacocinetica dei farmaci. Qui vediamo come possiamo calcolarla con alcuni esempi.
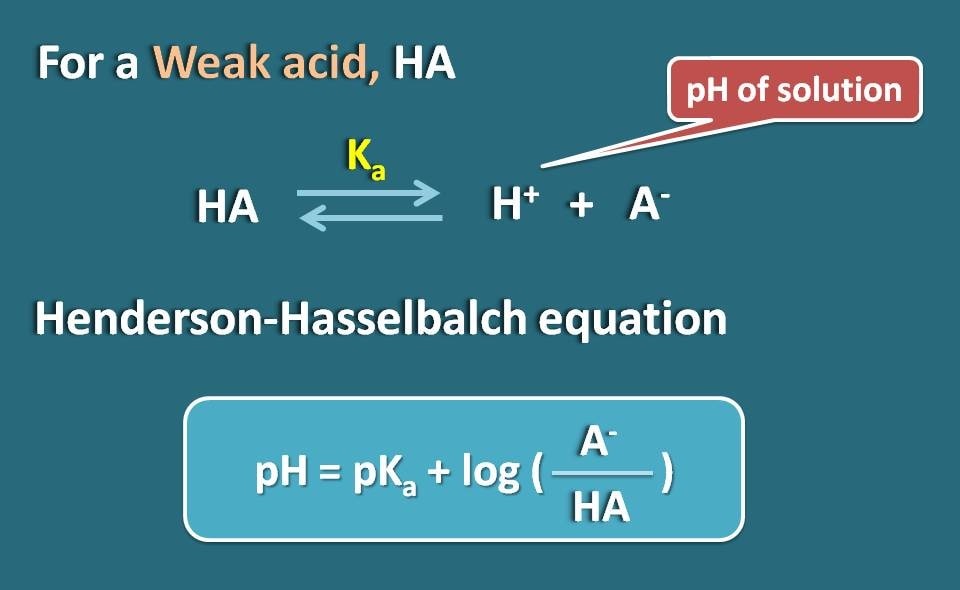
Equazione di Henderson-Hasselbalch
Prendiamo un elettrolita debole come l’HA che agisce come un acido debole. Quando si dissolve in acqua, non è completamente ionizzato ma raggiunge l’equilibrio in modo che possa esistere sia in forma ionizzata che in forma unificata.
Applicando l’equazione di Hendersen-Hasselbach per l’acido debole, possiamo mettere in relazione il pH della soluzione con il pKa del farmaco e la sua ionizzazione.
Così, pH=pKa + log(A-/HA)
dove A- è la forma ionizzata dell’acido debole mentre HA è la forma unionizzata.
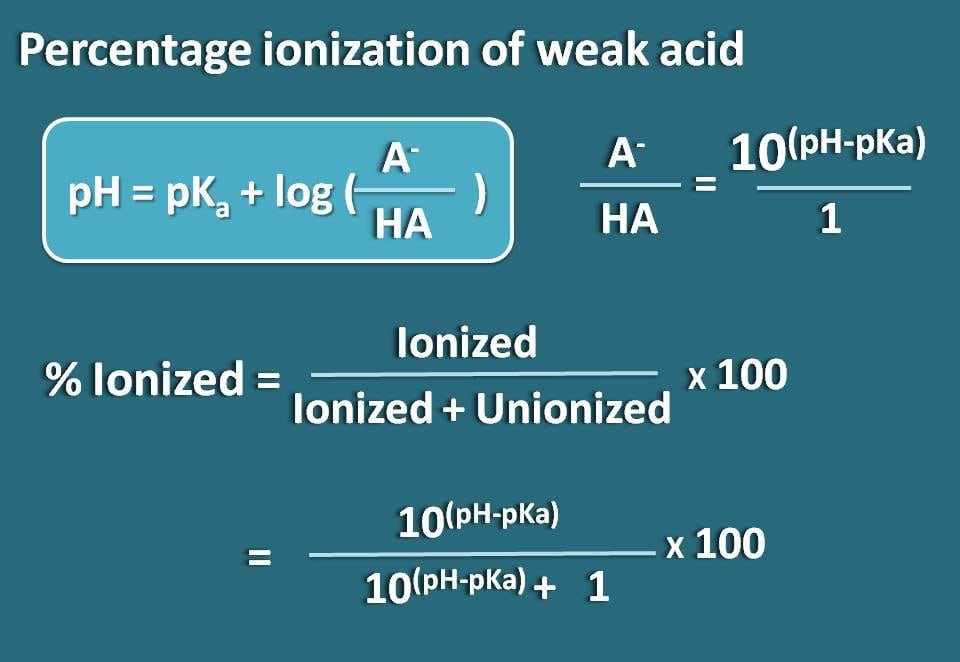
Ora riorganizziamo questa equazione in modo da ottenere il rapporto tra forme ionizzate e unionizzate dell’acido debole.
log(A-/HA)=pH – pKa
Prendendo l’antilogaritmo,
A-/HA=10(pH – pKa)
Ora, conosciamo il rapporto tra forma ionizzata e forma unionizzata. Da questo possiamo calcolare la percentuale di ionizzazione.
% ionizzato= * 100
Sostituendo in questa equazione,
% ionizzato=* 100
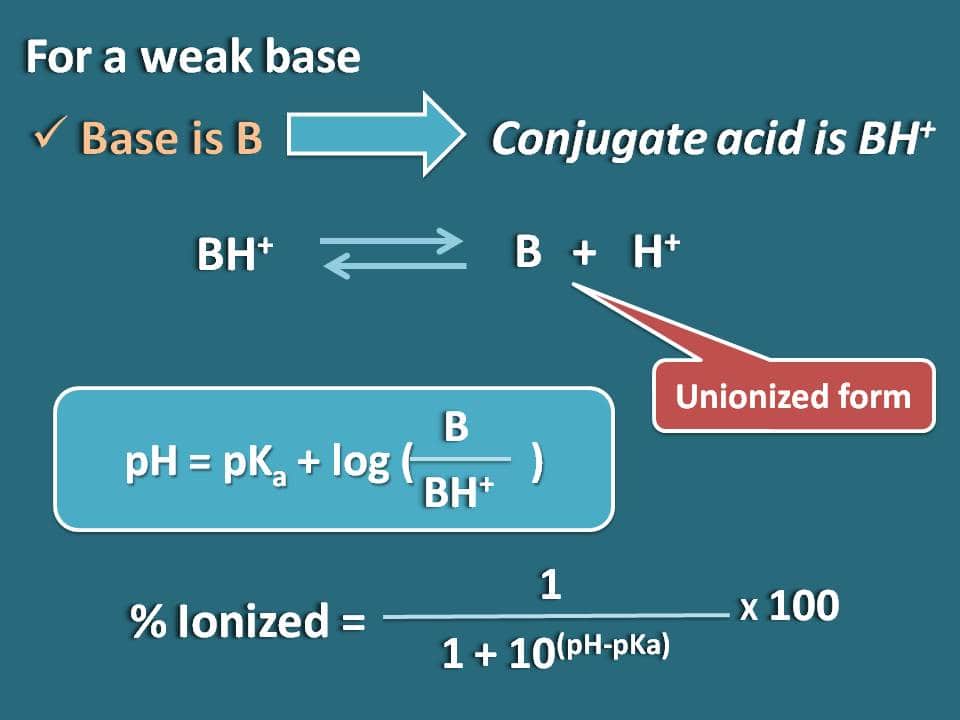
Similmente possiamo ottenere la formula per una base debole come B il cui acido coniugato è BH+. Ora possiamo scrivere l’equilibrio chimico per l’acido coniugato come segue.
Ora scrivere l’equazione di Hendersen-Hasselbalch per l’acido coniugato
pH=pKa + log (B/BH+)
Ora il rapporto tra le forme unionizzate e ionizzate della base può essere scritto come
B/BH+=10(pH – pKa)
Qui la parte della forma unionizzata è 10(pH – pKa) mentre la forma ionizzata è 1. Quindi la percentuale di ionizzazione sarà
% ionizzato=* 100
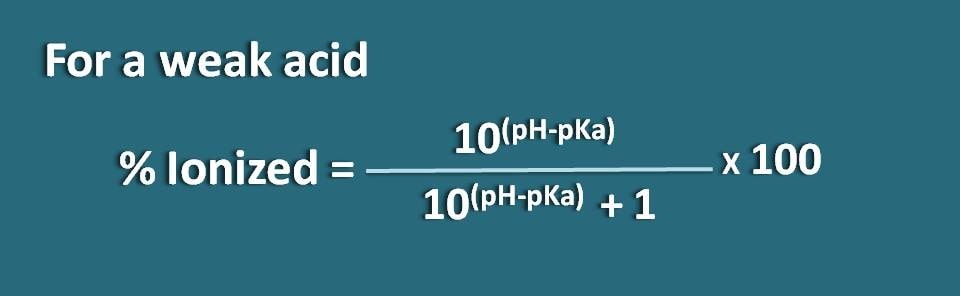
In alternativa, possiamo anche riorganizzare l’equazione di cui sopra invertendo il termine pH-pKa in pKa-pH dove otteniamo la formula come
% ionizzato=* 100
Ora andiamo con alcuni esempi pratici e vediamo come possiamo risolverli.
Esempio di lavoro 1
Calcolare la percentuale ionizzata di un farmaco debolmente acido ad un pH di 4.6 con valore pKa 8.6.
Soluzione:
Prima di tutto elenchiamo i dati forniti.
pH=4.6 e pKa=8.6
Siccome è un farmaco debolmente acido, applichiamo la seguente formula.
Sostituendo nell’equazione precedente,
% ionizzato=* 100
=1/1,01=0.99 %
Andiamo con un altro esempio.
Esempio di lavoro 2
Calcolare la frazione di farmaco nella forma ionizzata a pH 7.7 di un tessuto per un farmaco basico con pKa 8.7.
Soluzione:
Prima di tutto elenchiamo i dati forniti.
pH=7.7 e pKa=8.7
Qui si tratta di una base debole, quindi dobbiamo applicare la seguente formula.
Sostituendo nella precedente equazione,
% ionizzato=* 100
=100/1.1=90,9 %
Finalmente concludiamo con un altro esempio.
Esempio di lavoro 3
Calcolare il rapporto tra le forme protonate e non protonate della morfina a pH 5. La pKa della morfina è 7.
Soluzione:
Ancora una volta la data è pH=5 e pKa=7.
La morfina è un analgesico oppioide che ha un’ammina terziaria nell’anello e quindi agisce come base debole. Ma qui è stato chiesto il rapporto tra le forme protonate e non protonate del farmaco. La forma protonata non è altro che la forma ionizzata mentre la forma non protonata è la forma unionizzata. Per una base debole il rapporto sarà 10(pH – pKa) : 1.
e sostituiamo i valori.
Protonato/ non protonato=10(5 – 7)/1