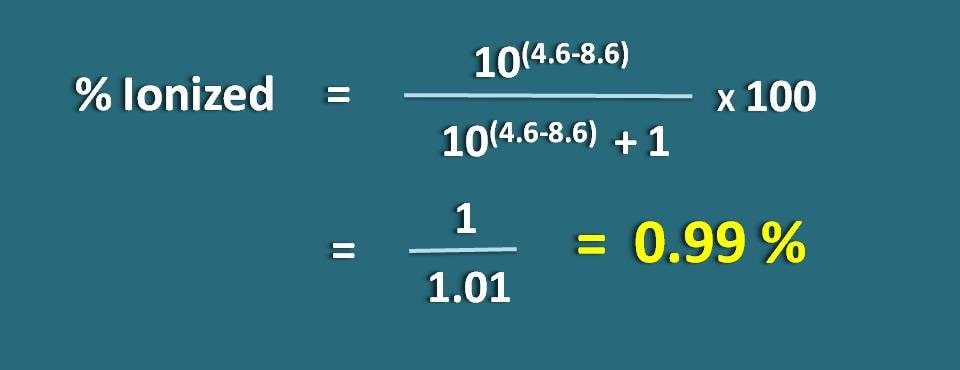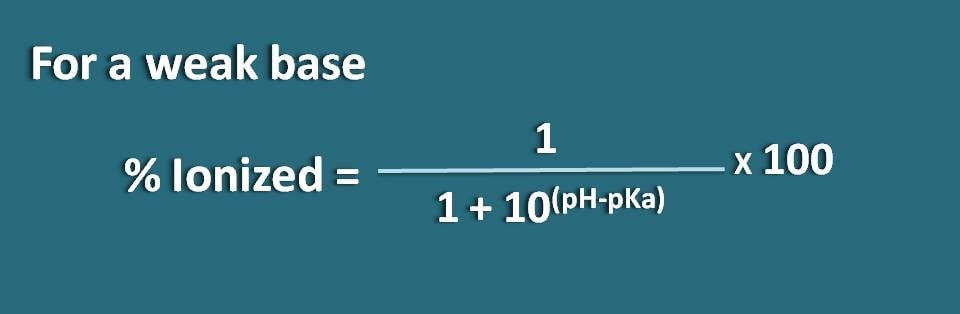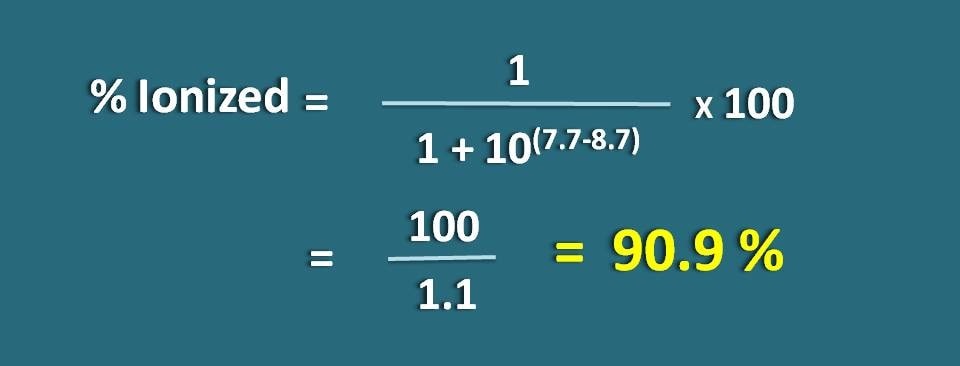A veces necesitamos conocer el estado de ionización de un compuesto orgánico para evaluar algunas de las propiedades fisicoquímicas del mismo. Por ejemplo, si el compuesto está más ionizado a un determinado pH, tendrá más solubilidad en agua. Por otro lado, si nos concentramos en la permeabilidad del compuesto a través de una membrana fisiológica, entonces la forma unionada del compuesto es más importante ya que será más lipofílica y puede cruzar la membrana lipofílica.
Así que, el cálculo del porcentaje de ionización es una tarea esencial que nos encontramos muchas veces mientras tratamos con la farmacocinética de los medicamentos. Aquí vamos a ver cómo podemos calcularlo junto con algunos ejemplos.
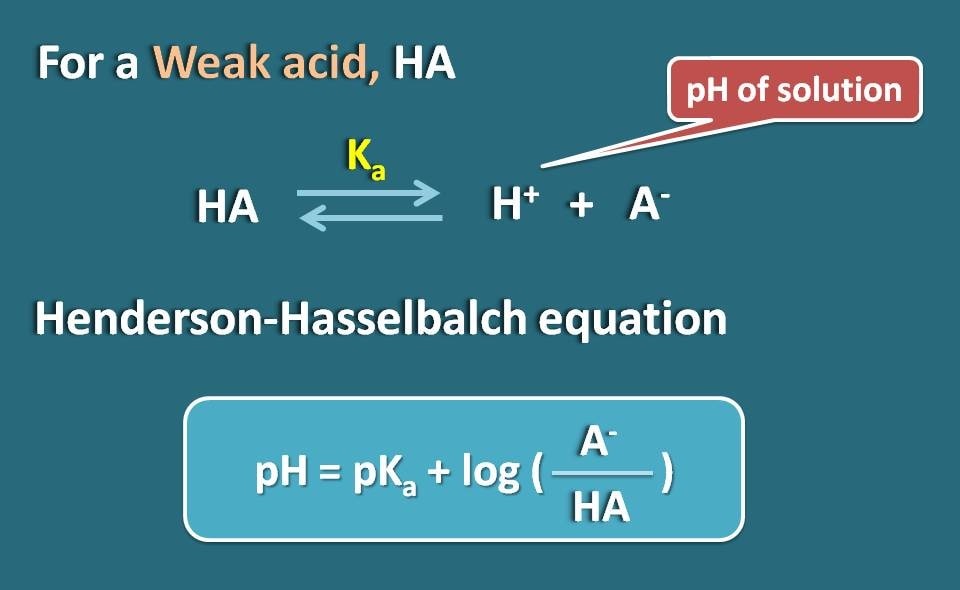
Ecuación de Henderson-Hasselbalch
Tomemos un electrolito débil como HA que actúa como un ácido débil. Cuando se disuelve en agua, no se ioniza completamente, sino que alcanza el equilibrio, de modo que puede existir tanto en forma ionizada como en forma unida.
Aplicando la ecuación de Hendersen-Hasselbach para el ácido débil, podemos relacionar el pH de la solución con el pKa del fármaco y su ionización.
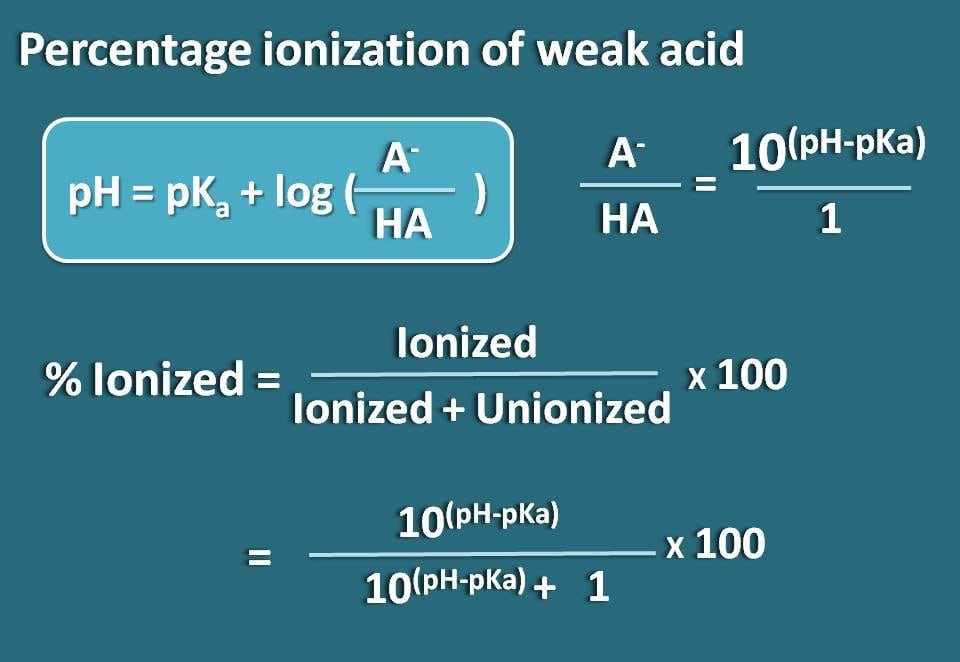
Así, pH=pKa + log(A-/HA)
Donde A- es la forma ionizada el ácido débil mientras que HA es la forma unida.
Ahora vamos a reordenar esta ecuación para que obtengamos la relación entre las formas ionizadas y unidas del ácido débil.
log(A-/HA)=pH – pKa
Tomando el antilogaritmo,
A-/HA=10(pH – pKa)
Ahora, conocemos la relación entre la forma ionizada y la forma unida. A partir de esto podemos calcular el porcentaje de ionización.
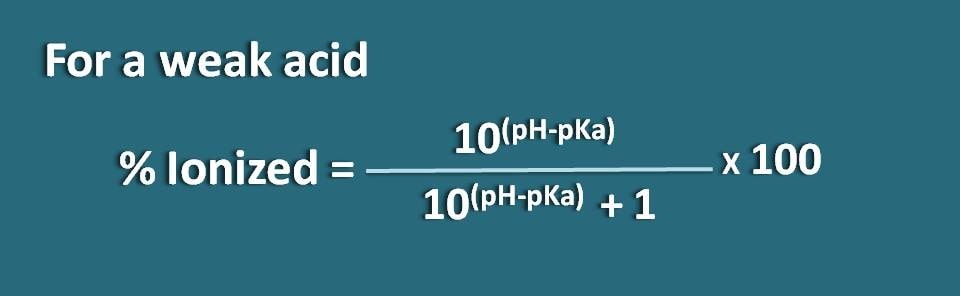
% ionizado= * 100
Sustituyendo en esta ecuación,
% ionizado=* 100
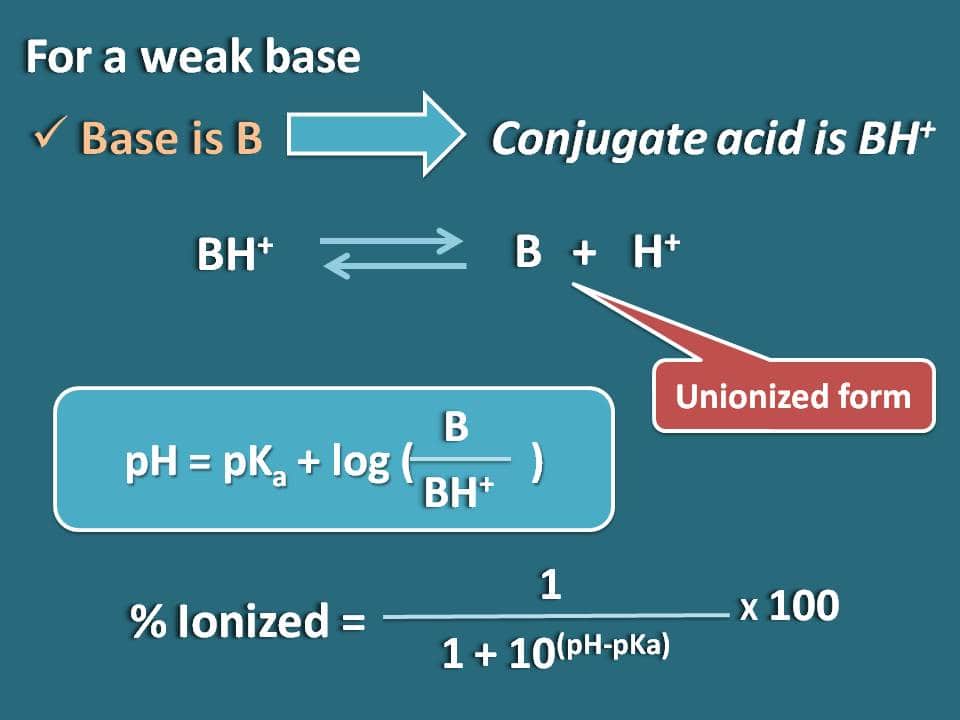
De forma similar podemos obtener la fórmula para una base débil como B cuyo ácido conjugado es BH+. Ahora podemos escribir el equilibrio químico para el ácido conjugado como se indica a continuación.
Ahora escribiendo la ecuación de Hendersen-Hasselbalch para el ácido conjugado
pH=pKa + log (B/BH+)
Ahora la relación entre las formas unidas y ionizadas de la base se puede escribir como
B/BH+=10(pH – pKa)
Aquí la parte de la forma unida es 10(pH – pKa) mientras que la forma ionizada es 1. Así que el porcentaje de ionización será
% ionizado=* 100
Alternativamente, también podemos reordenar la ecuación anterior invirtiendo el término pH-pKa en pKa-pH donde obtenemos la fórmula como
% ionizado=* 100
Ahora vamos con algunos de los ejemplos prácticos y veamos cómo podemos resolverlos.
Ejemplo práctico 1
Calcular el porcentaje de ionización de un fármaco débilmente ácido a un pH de 4,6 con un valor de pKa de 8,6.
Solución:
Primero vamos a enumerar los datos dados.
PH=4,6 y pKa=8,6
Como se trata de un fármaco débilmente ácido, vamos a aplicar la siguiente fórmula.
Sustituyendo en la ecuación anterior,
% ionizado=* 100
=1/1,01=0.99 %
Vamos con otro ejemplo.
Ejemplo de trabajo 2
Calcular la fracción de fármaco en la forma ionizada a pH 7.7 de un tejido para un fármaco básico con pKa 8,7.
Solución:
Primero vamos a enumerar los datos dados.
PH=7.7 y pKa=8,7
Aquí se trata de una base débil, por lo que tenemos que aplicar la siguiente fórmula.
Sustituyendo en la ecuación anterior,
% ionizado=* 100
=100/1.1=90,9 %
Finalmente concluimos con otro ejemplo.
Ejemplo de trabajo 3
Calcule la relación entre las formas protonadas y no protonadas de la morfina a pH 5. El pKa de la morfina es 7.
Solución:
De nuevo la fecha dada es pH=5 y pKa=7.
La morfina es un analgésico opioide que tiene amina terciaria en el anillo por lo tanto actúa como base débil. Pero aquí se preguntó la relación entre las formas protonadas y no protonadas de la droga. La forma protonada no es más que la forma ionizada mientras que la forma no protonada es la forma unida. Para una base débil la relación será 10(pH – pKa) : 1 .
y sustituyamos los valores.
Protonada/ no protonada=10(5 – 7)/1