Ce test démontre la capacité de certaines bactéries à décomposer l’acide aminé tryptophane en indole, qui s’accumule dans le milieu. Le test de production d’indole est important pour l’identification des entérobactéries. La plupart des souches d’E. coli, P. vulgaris, P. rettgeri, M. morgani et des espèces de Providencia décomposent l’acide aminé tryptophane avec libération d’indole. Cette décomposition est effectuée par une chaîne d’un certain nombre d’enzymes intracellulaires différentes, un système généralement appelé « tryptophanase ». Il est utilisé dans le cadre des procédures IMViC,a tests conçus pour distinguer les membres de la famille des Enterobacteriaceae.
Une variante de ce test utilisant le réactif d’Ehrlich (utilisant de l’alcool éthylique à la place de l’alcool isoamylique, développé par Paul Ehrlich) est utilisée lors de la réalisation du test sur les non-fermenteurs et les anaérobies.
Principe du test de l’indole
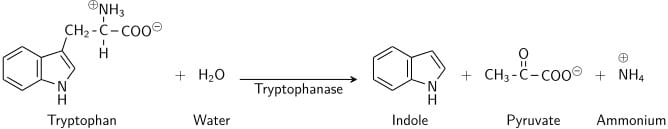
Le tryptophane est un acide aminé qui peut subir une désamination et une hydrolyse par les bactéries qui expriment l’enzyme tryptophanase. L’indole est généré par désamination réductrice à partir du tryptophane via la molécule intermédiaire qu’est l’acide indolepyruvique. La tryptophanase catalyse la réaction de désamination, au cours de laquelle le groupe amine (-NH2) de la molécule de tryptophane est éliminé. Les produits finaux de la réaction sont l’indole, l’acide pyruvique, l’ammonium (NH4+) et l’énergie. Le pyridoxal phosphate est nécessaire en tant que coenzyme.
Lorsque l’indole est combiné au réactif de Kovac (qui contient de l’acide chlorhydrique et du p-diméthylaminobenzaldéhyde dans de l’alcool amylique), la solution passe du jaune au rouge cerise. L’alcool amylique n’étant pas soluble dans l’eau, la coloration rouge se forme dans une couche huileuse au sommet du bouillon.
Dans le test ponctuel, l’indole se combine, dans la matrice de papier filtre, à un pH acide avec le p-Diméthylaminocinnamaldéhyde (DMACA) pour produire un composé bleu à bleu-vert. Le Réactif Spot Indole a été signalé comme étant utile pour détecter la production d’indole par les membres de la famille des Enterobacteriaceae et certaines espèces anaérobies.
Réactifs utilisés dans le test de l’indole
Ingrédients par litre :*
| réactif ponctuel à l’indole : | |
| p-Diméthylaminocinnamaldéhyde (DMACA) | 10.0 gm |
| Acide hydrochlorique, 37% | 100.0 ml | Eau déionisée | 900.0 ml |
| Réactif Indole Kovacs : | |
| p-Diméthylaminobenzaldéhyde | 50.0 gm | Acide hydrochlorique, 37% | 250,0 ml |
| Alcool amylique | 750.0 ml |
* Ajusté et/ou complété au besoin pour répondre aux critères de performance.
Procédure du test de l’indole
- Prenez un tube à essai stérilisé contenant 4 ml de bouillon de tryptophane.
- Inoculer le tube de manière aseptique en prenant la croissance de 18 à 24 h de culture.
- Incuber le tube à 37°C pendant 24 à 28 heures.
- Ajouter 0,5 ml de réactif de Kovac au bouillon de culture.
- Observer la présence ou l’absence d’anneau.
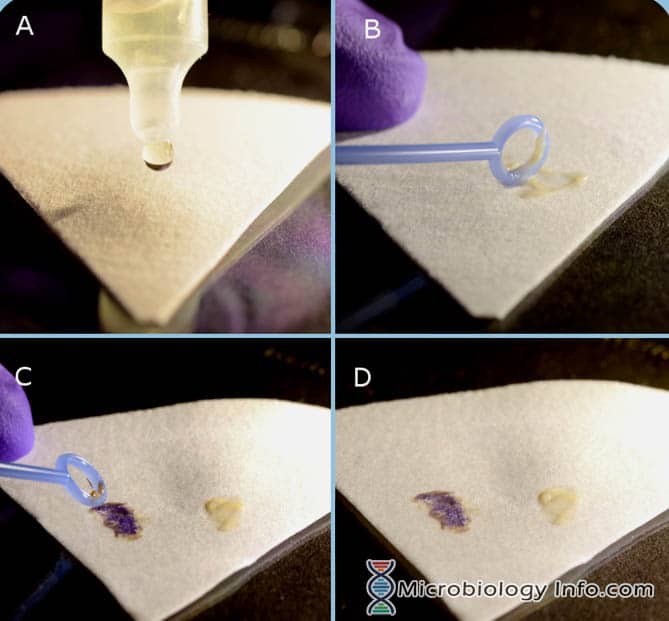
Procédure de réactif indole spot (DMACA)
- Placer plusieurs gouttes de réactif indole spot sur un morceau de papier filtre.
- Avec une anse d’inoculation ou un bâtonnet applicateur en bois, prélever une portion d’une colonie isolée à 18-24 heures sur un milieu non sélectif et la frotter sur la zone saturée en réactif du papier filtre.
- Examiner immédiatement
Interprétation du résultat du test à l’indole

Positif : Formation d’une couleur rose à rouge (« anneau rouge cerise ») dans la couche de réactif sur le dessus du milieu dans les secondes qui suivent l’ajout du réactif.
Exemples : Aeromonas hydrophila, Aeromonas punctata, Bacillus alvei,Edwardsiella sp., Escherichia coli, Flavobacterium sp, Haemophilus influenzae, Klebsiella oxytoca, Proteus sp. (pas P. mirabilis et P. penneri), Plesiomonas shigelloides,Pasteurella multocida, Pasteurella pneumotropica, Enterococcus faecalis et Vibrio sp.
Négatif : Pas de changement de couleur même après l’ajout du réactif approprié.
Exemples : Actinobacillus spp, Aeromonas salmonicida, Alcaligenes sp, la plupart des Bacillus sp, Bordetella sp, Enterobacter sp, Lactobacillus spp, la plupart des Haemophilus sp, la plupart des Klebsiella sp, Neisseria sp, Pasteurella haemolytica, Pasteurella ureae, Proteus mirabilis, P. penneri, Pseudomonas sp.,Salmonella sp., Serratia sp., Yersinia sp.
Résultat du réactif indole Spot
Réaction positive : Le développement d’une couleur bleue dans les 3 minutes.
Réaction négative : Le développement d’une couleur rose dans les 3 minutes.
Test ponctuel à l’indole
Méthode
- Déposer plusieurs gouttes de réactif p-diméthylaminocinnamaldéhyde à 1% sur un morceau de papier filtre jusqu’à saturation.
- Avec une anse d’inoculation ou un bâtonnet applicateur en bois, prélever une portion d’une colonie isolée à 18-24 heures dans un milieu non sélectif et la frotter sur la zone saturée de réactif du papier filtre.
- Observer le développement de la couleur dans un délai de 1 à 3 minutes.
Résultats attendus
- Positif : Une réaction positive est dénotée par l’apparition d’un changement de couleur bleu à bleu-vert sur le frottis bactérien dans les 2 à 3 minutes.
- Négatif : Les réactions négatives restent incolores ou rose clair.
Note : La réaction positive est rouge-violet dans le cas de Providencia alcalifaciens.
Utilisations du test d’indole
- Pour différencier Proteus mirabilis (indole négatif) de toutes les autres espèces de Proteus (indole positif).
- Pour différencier Klebssiella pneumoniae (indole négatif) de Klebsiella oxytoca (indole positif).
- Pour différencier Citrobacter freundii (indole négatif) de Citrobacter koseri (indole positif).
Contrôle de qualité pour le test à l’indole
Contrôle positif : Escherichia coli NCTC 10418
Contrôle négatif : Proteus mirabilis NCTC 10975
Limitations du test à l’indole
- Les tests à l’indole peuvent être utilisés comme une aide à l’identification et à la différenciation des organismes à gram positif et à gram négatif. Des tests biochimiques supplémentaires utilisant des cultures pures sont recommandés pour une identification complète.
- Le test en tube est une méthode plus sensible de détection de l’indole que le test ponctuel.
- Lorsqu’on effectue un test ponctuel, le réactif indole de Kovacs peut être utilisé comme substitut du réactif du test ponctuel. Cependant, le réactif à l’indole de Kovacs, lorsqu’il est utilisé comme réactif pour le test ponctuel, est moins sensible pour détecter l’indole que le réactif ponctuel à l’indole (DMACA).
- Le réactif à l’indole de Kovacs n’est pas recommandé pour une utilisation avec des bactéries anaérobies. Le réactif indole spot (DMACA) est adapté à l’utilisation des anaérobies.
- Puisqu’il a été démontré que les peptones varient en ce qui concerne leur aptitude à l’utilisation pour le test de l’indole, les milieux sélectionnés pour la détermination de l’indole doivent être testés avec des organismes positifs et négatifs connus afin d’assurer leur aptitude.
- Les milieux contenant du glucose ne doivent pas être utilisés pour le test de l’indole en raison de la formation de produits finaux acides dont il a été démontré qu’ils réduisent la production d’indole. La gélose Mueller Hinton ne doit pas non plus être utilisée pour ce test car le tryptophane est détruit pendant l’hydrolyse acide de la caséine.
- Les milieux contenant des colorants, tels que MacConkey et EMB, ne sont pas des sources d’inoculum appropriées en raison de l’entraînement possible du colorant et de l’interférence subséquente de l’interprétation de la couleur de l’indole.
- Les colonies indole-positives ont été signalées comme faisant apparaître les colonies indole-négatives adjacentes comme faussement positives en raison de la diffusion de l’indole dans les milieux. Pour éviter les faux positifs, sélectionnez des colonies de morphologies différentes séparées d’au moins 5 mm pour le test à l’indole.