Dieser Test zeigt die Fähigkeit bestimmter Bakterien, die Aminosäure Tryptophan zu Indol abzubauen, das sich im Medium anreichert. Der Indolproduktionstest ist wichtig für die Identifizierung von Enterobakterien. Die meisten Stämme von E. coli, P. vulgaris, P. rettgeri, M. morgani und Providencia-Arten bauen die Aminosäure Tryptophan unter Freisetzung von Indol ab. Dies geschieht durch eine Kette von verschiedenen intrazellulären Enzymen, ein System, das allgemein als „Tryptophanase“ bezeichnet wird. Er wird als Teil des IMViC-Verfahrens verwendet, einem Test zur Unterscheidung von Mitgliedern der Familie Enterobacteriaceae.
Eine Variation dieses Tests unter Verwendung des Ehrlich’schen Reagens (unter Verwendung von Ethylalkohol anstelle von Isoamylalkohol, entwickelt von Paul Ehrlich) wird bei der Durchführung des Tests bei Nicht-Fermentern und Anaerobiern verwendet.
Prinzip des Indol-Tests
Tryptophan ist eine Aminosäure, die von Bakterien, die das Enzym Tryptophanase exprimieren, deaminiert und hydrolysiert werden kann. Indol wird durch reduktive Desaminierung aus Tryptophan über das Zwischenmolekül Indolbrenztraubensäure gebildet. Die Tryptophanase katalysiert die Desaminierungsreaktion, bei der die Amin-Gruppe (-NH2) des Tryptophan-Moleküls entfernt wird. Endprodukte der Reaktion sind Indol, Brenztraubensäure, Ammonium (NH4+) und Energie. Als Coenzym wird Pyridoxalphosphat benötigt.
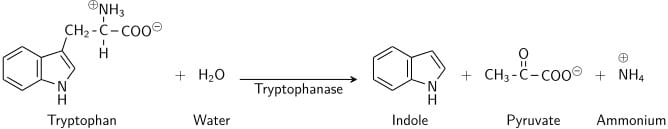
Wenn Indol mit Kovacs Reagenz (das Salzsäure und p-Dimethylaminobenzaldehyd in Amylalkohol enthält) kombiniert wird, färbt sich die Lösung von gelb nach kirschrot. Da Amylalkohol nicht wasserlöslich ist, bildet sich die Rotfärbung in einer öligen Schicht am oberen Rand der Brühe.
Im Spot-Test verbindet sich Indol in der Filterpapiermatrix bei einem sauren pH-Wert mit p-Dimethylaminocinnamaldehyd (DMACA) zu einer blauen bis blau-grünen Verbindung. Das Indol-Spot-Reagenz hat sich als nützlich erwiesen, um die Indolproduktion von Mitgliedern der Familie Enterobacteriaceae und bestimmten anaeroben Arten nachzuweisen.
Reagenzien für den Indol-Test
Inhaltsstoffe pro Liter:*
| Indol Spot Reagenz: | |
| p-Dimethylaminocinnamaldehyd (DMACA) | 10.0 gm |
| Salzsäure, 37% | 100.0 ml |
| Deionisiertes Wasser | 900.0 ml |
| Indol Kovacs Reagenz: | |
| p-Dimethylaminobenzaldehyd | 50.0 gm |
| Salzsäure, 37% | 250,0 ml |
| Amylalkohol | 750.0 ml |
* Nach Bedarf eingestellt und/oder ergänzt, um die Leistungskriterien zu erfüllen.
Vorgehensweise des Indol-Tests
- Nehmen Sie ein sterilisiertes Reagenzglas mit 4 ml Tryptophanbrühe.
- Inokulieren Sie das Röhrchen aseptisch, indem Sie das Wachstum von der 18- bis 24-stündigen Kultur nehmen.
- Inkubieren Sie das Röhrchen bei 37°C für 24-28 Stunden.
- Geben Sie 0,5 ml Kovacs Reagenz zu der Brühkultur.
- Beobachten Sie das Vorhandensein oder Fehlen eines Rings.
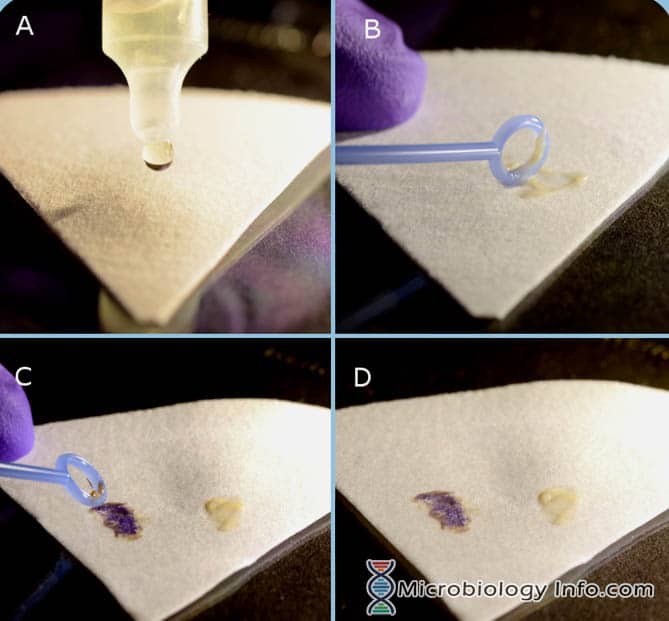
Indol-Spot-Reagenz (DMACA) Verfahren
- Tropfen Sie einige Tropfen Indol-Spot-Reagenz auf ein Stück Filterpapier.
- Wählen Sie mit einer Impföse oder einem hölzernen Applikatorstäbchen einen Teil einer 18-24 Stunden isolierten Kolonie von einem nicht-selektiven Medium und reiben Sie ihn auf den reagenzgesättigten Bereich des Filterpapiers.
- Sofort untersuchen
Ergebnis Interpretation des Indol-Tests

Positiv: Bildung einer rosa bis roten Farbe („kirschroter Ring“) in der Reagenzschicht auf dem Medium innerhalb von Sekunden nach Zugabe des Reagenzes.
Beispiele: Aeromonas hydrophila, Aeromonas punctata, Bacillus alvei,Edwardsiella sp., Escherichia coli, Flavobacterium sp, Haemophilus influenzae, Klebsiella oxytoca, Proteus sp. (nicht P. mirabilis und P. penneri), Plesiomonas shigelloides,Pasteurella multocida, Pasteurella pneumotropica, Enterococcus faecalis, und Vibrio sp.
Negativ: Kein Farbumschlag auch nach Zugabe von entsprechendem Reagenz.
Beispiele: Actinobacillus spp., Aeromonas salmonicida, Alcaligenes sp., die meisten Bacillus sp., Bordetella sp., Enterobacter sp., Lactobacillus spp., die meisten Haemophilus sp., die meisten Klebsiella sp., Neisseria sp, Pasteurella haemolytica, Pasteurella ureae, Proteus mirabilis, P. penneri, Pseudomonas sp.,Salmonella sp., Serratia sp., Yersinia sp.
Indol Spot Reagent Ergebnis
Positive Reaktion: Die Entwicklung einer blauen Farbe innerhalb von 3 Minuten.
Negative Reaktion: Die Entwicklung einer rosa Farbe innerhalb von 3 Minuten.
Spot-Indol-Test
Methode
- Tropfen Sie einige Tropfen 1% p-Dimethylaminocinnamaldehyd-Reagenz auf ein Stück Filterpapier bis zur Sättigung.
- Mit einer Impföse oder einem hölzernen Applikatorstäbchen einen Teil einer 18-24 Stunden isolierten Kolonie von einem nicht-selektiven Medium entnehmen und auf den mit Reagenz gesättigten Bereich des Filterpapiers reiben.
- Beobachten Sie die Farbentwicklung innerhalb von 1 bis 3 Minuten.
Erwartete Ergebnisse
- Positiv: Eine positive Reaktion wird durch das Auftreten einer blauen bis blaugrünen Farbveränderung auf dem bakteriellen Abstrich innerhalb von 2 bis 3 Minuten angezeigt.
- Negativ: Negative Reaktionen bleiben farblos oder hellrosa.
Hinweis: Bei Providencia alcalifaciens ist die positive Reaktion rot-violett.
Verwendung des Indol Tests
- Zur Unterscheidung von Proteus mirabilis (Indol negativ) von allen anderen Proteus-Arten (Indol positiv).
- Zur Unterscheidung von Klebssiella pneumoniae (indol-negativ) von Klebsiella oxytoca (indol-positiv).
- Zur Unterscheidung von Citrobacter freundii (indol-negativ) von Citrobacter koseri (indol-positiv).
Qualitätskontrolle für Indol-Test
Positivkontrolle: Escherichia coli NCTC 10418
Negative Kontrolle: Proteus mirabilis NCTC 10975
Einschränkungen des Indol-Tests
- Indol-Tests können als Hilfsmittel bei der Identifizierung und Differenzierung von gram-positiven und gram-negativen Organismen verwendet werden. Für eine vollständige Identifizierung werden zusätzliche biochemische Tests unter Verwendung von Reinkulturen empfohlen.
- Der Röhrchentest ist eine empfindlichere Methode zum Nachweis von Indol als der Spot-Test.
- Bei der Durchführung eines Spot-Tests kann das Kovacs Indol-Reagenz als Ersatz für das Spot-Test-Reagenz verwendet werden. Allerdings ist das Kovacs Indol-Reagenz, wenn es als Spottest-Reagenz verwendet wird, weniger empfindlich beim Nachweis von Indol als das Indol-Spot-Reagenz (DMACA).
- Kovacs Indol-Reagenz wird nicht zur Verwendung mit anaeroben Bakterien empfohlen. Das Indol-Spot-Reagenz (DMACA) ist für die Verwendung mit Anaerobiern geeignet.
- Da Peptone nachweislich hinsichtlich ihrer Eignung für die Verwendung bei Indol-Tests variieren, sollten Medien, die für die Indol-Bestimmung ausgewählt werden, mit bekannten positiven und negativen Organismen getestet werden, um die Eignung sicherzustellen.
- Glukosehaltige Medien sollten nicht für Indol-Tests verwendet werden, da sie saure Endprodukte bilden, die nachweislich die Indol-Produktion reduzieren. Mueller Hinton Agar sollte ebenfalls nicht für diesen Test verwendet werden, da Tryptophan während der sauren Hydrolyse von Casein zerstört wird.
- Farbstoffhaltige Medien wie MacConkey und EMB sind aufgrund der möglichen Verschleppung von Farbstoff und der daraus resultierenden Störung der Indol-Farbinterpretation als Inokulumquelle ungeeignet.
- Indol-positive Kolonien haben Berichten zufolge dazu geführt, dass benachbarte Indol-negative Kolonien aufgrund der Diffusion von Indol in das Medium falsch-positiv erscheinen. Um falsch-positive Ergebnisse zu vermeiden, wählen Sie Kolonien mit unterschiedlicher Morphologie, die mindestens 5 mm voneinander entfernt sind, für den Indol-Test aus.