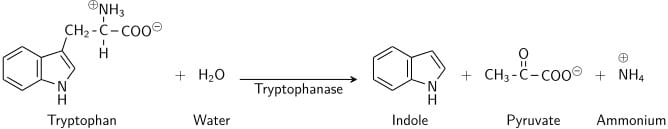
Esta prueba demuestra la capacidad de ciertas bacterias para descomponer el aminoácido triptófano en indol, que se acumula en el medio. La prueba de producción de indol es importante para la identificación de Enterobacterias. La mayoría de las cepas de E. coli, P. vulgaris, P. rettgeri, M. morgani y Providencia descomponen el aminoácido triptófano con la liberación de indol. Esto se lleva a cabo mediante una cadena de varias enzimas intracelulares diferentes, un sistema generalmente denominado «triptófano». Se utiliza como parte de los procedimientos IMViC,a pruebas diseñadas para distinguir entre los miembros de la familia Enterobacteriaceae.
Una variación de esta prueba que utiliza el reactivo de Ehrlich (utilizando alcohol etílico en lugar de alcohol isoamílico, desarrollado por Paul Ehrlich) se utiliza cuando se realiza la prueba en no fermentadores y anaerobios.
Principio de la prueba del indol
El triptófano es un aminoácido que puede sufrir desaminación e hidrólisis por parte de las bacterias que expresan la enzima triptófana. El indol se genera por desaminación reductora a partir del triptófano a través de la molécula intermedia ácido indolopirúvico. La triptófanasa cataliza la reacción de desaminación, durante la cual se elimina el grupo amina (-NH2) de la molécula de triptófano. Los productos finales de la reacción son indol, ácido pirúvico, amonio (NH4+) y energía. El fosfato de piridoxal se requiere como coenzima.
Cuando el indol se combina con el reactivo de Kovac (que contiene ácido clorhídrico y p-dimetilaminobenzaldehído en alcohol amílico) la solución pasa de amarillo a rojo cereza. Dado que el alcohol amílico no es soluble en agua, la coloración roja se formará en una capa aceitosa en la parte superior del caldo.
En la prueba del punto, el indol se combina, en la matriz del papel de filtro, a un pH ácido con el p-dimetilaminocinamaldehído (DMACA) para producir un compuesto de color azul a azul-verde. Se ha informado de que el reactivo Indole Spot es útil para detectar la producción de indol por parte de miembros de la familia Enterobacteriaceae y ciertas especies anaerobias.
Reactivos utilizados en la prueba del indol
Ingredientes por litro:*
| Reactivo de indol: | |
| p-Dimetilaminocinamaldehído (DMACA) | 10.0 gm | Ácido clorhídrico, 37% | 100.0 ml |
| Agua desionizada | 900.0 ml |
| Reactivo de Kovacs: | |
| p-Dimetilaminobenzaldehído | 50.0 gm |
| Ácido clorhídrico, 37% | 250,0 ml |
| Alcohol amílico | 750.0 ml |
* Ajustado y/o complementado según se requiera para cumplir con los criterios de rendimiento.
Procedimiento de la prueba de indol
- Tomar un tubo de ensayo esterilizado que contenga 4 ml de caldo de triptófano.
- Inocular el tubo asépticamente tomando el crecimiento de 18 a 24 horas de cultivo.
- Incubrir el tubo a 37°C durante 24-28 horas.
- Añadir 0,5 ml de reactivo de Kovac al cultivo de caldo.
- Observar la presencia o ausencia de anillo.
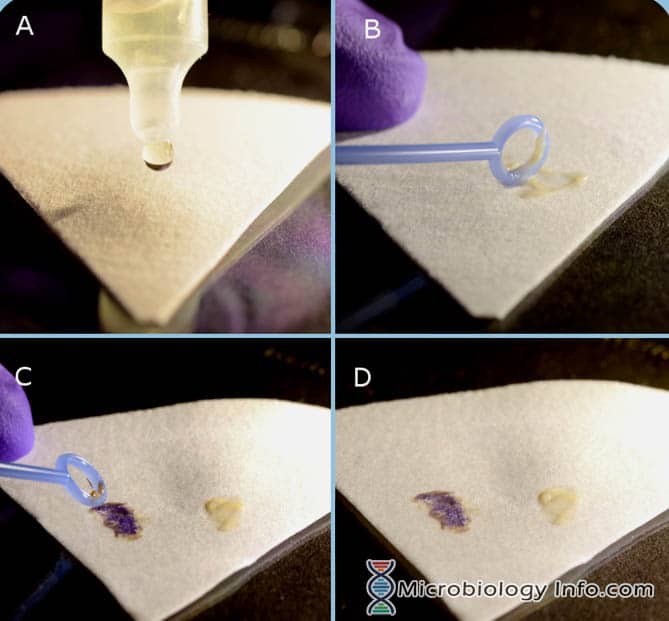
Procedimiento con el reactivo de manchas de indol (DMACA)
- Colocar varias gotas de reactivo de manchas de indol en un trozo de papel de filtro.
- Con un bucle de inoculación o un palito aplicador de madera, coger una porción de una colonia aislada de 18-24 horas de un medio no selectivo y frotarla en la zona saturada de reactivo del papel de filtro.
- Examinar inmediatamente
Interpretación del resultado de la prueba del indol

Positivo: Formación de un color entre rosa y rojo («anillo rojo cereza») en la capa de reactivo sobre el medio a los pocos segundos de añadir el reactivo.
Ejemplos: Aeromonas hydrophila, Aeromonas punctata, Bacillus alvei,Edwardsiella sp., Escherichia coli, Flavobacterium sp., Haemophilus influenzae, Klebsiella oxytoca, Proteus sp. (no P. mirabilis y P. penneri), Plesiomonas shigelloides,Pasteurella multocida, Pasteurella pneumotropica, Enterococcus faecalis y Vibrio sp.
Negativo: No hay cambio de color incluso después de la adición del reactivo apropiado.
Ejemplos: Actinobacillus spp., Aeromonas salmonicida, Alcaligenes sp., la mayoría de Bacillus sp., Bordetella sp., Enterobacter sp., Lactobacillus spp., la mayoría de Haemophilus sp., la mayoría de Klebsiella sp., Neisseria sp, Pasteurella haemolytica, Pasteurella ureae, Proteus mirabilis, P. penneri, Pseudomonas sp.,Salmonella sp., Serratia sp., Yersinia sp.
Resultado del reactivo de manchas de indol
Reacción positiva: El desarrollo de un color azul en 3 minutos.
Reacción negativa: El desarrollo de un color rosa en 3 minutos.
Prueba de indol puntual
Método
- Colocar varias gotas de reactivo de p-dimetilaminocinamaldehído al 1% en un trozo de papel de filtro hasta su saturación.
- Con un bucle de inoculación o un palillo aplicador de madera, recoger una porción de una colonia aislada de 18 a 24 horas de un medio no selectivo y frotarla sobre la zona saturada de reactivo del papel de filtro.
- Observar el desarrollo del color en un plazo de 1 a 3 minutos.
Resultados esperados
- Positivos: Una reacción positiva se denota por la aparición de un cambio de color azul a azul-verde en el frotis bacteriano en 2-3 minutos.
- Negativo: Las reacciones negativas permanecen incoloras o de color rosa claro.
Nota: La reacción positiva es de color rojo-violeta en el caso de Providencia alcalifaciens.
Usos de la prueba de indol
- Para diferenciar Proteus mirabilis (indol negativo) de todas las demás especies de Proteus (indol positivo).
- Para diferenciar Klebssiella pneumoniae (indol negativo) de Klebsiella oxytoca (indol positivo).
- Para diferenciar Citrobacter freundii (indol negativo) de Citrobacter koseri (indol positivo).
Control de calidad para la prueba de indol
Control positivo: Escherichia coli NCTC 10418
Control negativo: Proteus mirabilis NCTC 10975
Limitaciones de la prueba de indol
- Las pruebas de indol pueden utilizarse como ayuda en la identificación y diferenciación de organismos grampositivos y gramnegativos. Se recomienda realizar pruebas bioquímicas adicionales utilizando cultivos puros para una identificación completa.
- La prueba del tubo es un método más sensible para detectar el indol que la prueba puntual.
- Cuando se realiza una prueba puntual, el reactivo Kovacs Indole puede utilizarse como sustituto del reactivo de la prueba puntual. Sin embargo, el reactivo Kovacs Indole Reagent, cuando se utiliza como reactivo de la prueba puntual, es menos sensible para detectar el indol que el reactivo Indole Spot Reagent (DMACA).
- El reactivo Kovacs Indole Reagent no se recomienda para su uso con bacterias anaerobias. El Indole Spot Reagent (DMACA) es adecuado para el uso con anaerobios.
- Dado que se ha demostrado que las peptonas varían en cuanto a su idoneidad para el uso con pruebas de indol, los medios seleccionados para la determinación de indol deben probarse con organismos positivos y negativos conocidos para asegurar su idoneidad.
- Los medios que contienen glucosa no deben utilizarse para pruebas de indol debido a la formación de productos finales ácidos que han demostrado reducir la producción de indol. El agar Mueller Hinton tampoco debe utilizarse para esta prueba porque el triptófano se destruye durante la hidrólisis ácida de la caseína.
- Los medios que contienen colorante, como MacConkey y EMB, no son fuentes adecuadas de inóculo debido a la posible transferencia del colorante y la consiguiente interferencia en la interpretación del color del indol.
- Se ha informado de que las colonias positivas al indol hacen que las colonias adyacentes negativas al indol aparezcan como falsas positivas debido a la difusión del indol en los medios. Para evitar falsos positivos, seleccione colonias de diferentes morfologías que estén separadas por al menos 5 mm para la prueba de indol.