Questo test dimostra la capacità di alcuni batteri di decomporre l’aminoacido triptofano in indolo, che si accumula nel mezzo. Il test di produzione di indolo è importante per l’identificazione degli Enterobatteri. La maggior parte dei ceppi di E. coli, P. vulgaris, P. rettgeri, M. morgani e Providencia spezzano l’aminoacido triptofano con il rilascio di indolo. Questo viene eseguito da una catena di diversi enzimi intracellulari, un sistema generalmente indicato come “triptofanasi”. Viene utilizzato come parte delle procedure IMViC, un test progettato per distinguere tra i membri della famiglia delle Enterobacteriaceae.
Una variazione di questo test che utilizza il reagente di Ehrlich (utilizzando l’alcol etilico al posto dell’alcol isoamilico, sviluppato da Paul Ehrlich) viene utilizzato quando si esegue il test su non fermentatori e anaerobi.
Principio del test dell’indolo
Il triptofano è un aminoacido che può essere sottoposto a deaminazione e idrolisi dai batteri che esprimono l’enzima triptofanasi. L’indolo è generato dalla deaminazione riduttiva dal triptofano attraverso la molecola intermedia dell’acido indolepiruvico. La triptofanasi catalizza la reazione di deaminazione, durante la quale il gruppo amminico (-NH2) della molecola di triptofano viene rimosso. I prodotti finali della reazione sono indolo, acido piruvico, ammonio (NH4+) ed energia. Il fosfato piridossale è richiesto come coenzima.
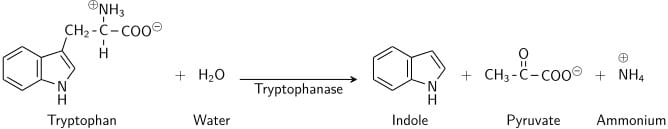
Quando l’indolo è combinato con il reagente di Kovac (che contiene acido cloridrico e p-dimetilamminobenzaldeide in alcool amilico) la soluzione passa dal giallo al rosso ciliegia. Poiché l’alcool amilico non è solubile in acqua, la colorazione rossa si formerà in uno strato oleoso nella parte superiore del brodo.
Nel test spot, l’indolo si combina, nella matrice di carta da filtro, ad un pH acido con la p-dimetilaminocinnamaldeide (DMACA) per produrre un composto blu o blu-verde. È stato riportato che l’Indole Spot Reagent è utile per rilevare la produzione di indolo da parte dei membri della famiglia delle Enterobacteriaceae e di alcune specie anaerobiche.
Reagenti usati nel test dell’indolo
Ingredienti per litro:*
| Reagente spot indolo: | |
| p-Dimetilaminocinnamaldeide (DMACA) | 10.0 gm |
| Acido cloridrico, 37% | 100.0 ml |
| Acqua deionizzata | 900.0 ml |
| Reagente Indolo Kovacs: | ||
| p-Dimetilamminobenzaldeide | 50.0 gm | |
| Acido cloridrico, 37% | 250.0 ml | |
| Alcool amilico | 750.0 ml | |
* Aggiustato e/o integrato come richiesto per soddisfare i criteri di prestazione.
Procedura del test dell’indolo
- Prendere una provetta sterilizzata contenente 4 ml di brodo di triptofano.
- Inoculare la provetta in modo asettico prendendo la crescita da 18 a 24 ore di coltura.
- Incubare la provetta a 37°C per 24-28 ore.
- Aggiungere 0,5 ml di reagente di Kovac alla coltura in brodo.
- Osservare per la presenza o assenza di anello.
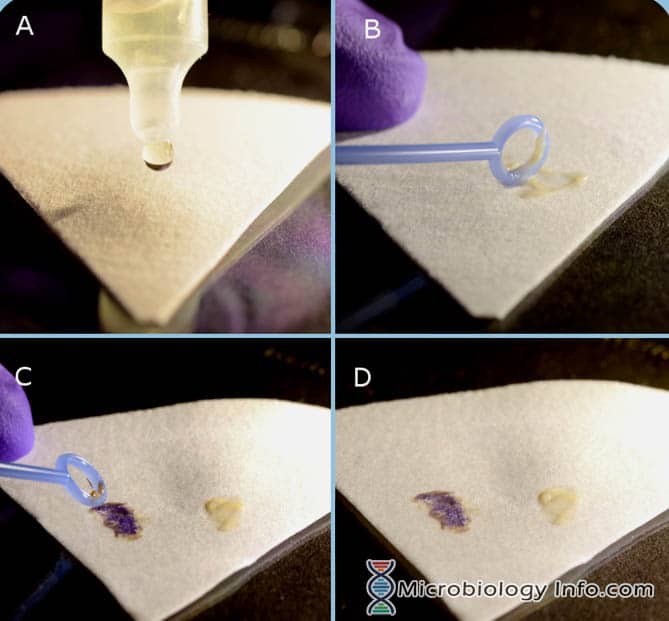
Procedimento del reagente Indole Spot (DMACA)
- Porre alcune gocce di reagente Indole Spot su un pezzo di carta da filtro.
- Con un anello inoculante o un bastoncino di legno, prelevare una porzione di una colonia isolata da 18-24 ore da un terreno non selettivo e strofinarla sull’area satura di reagente della carta da filtro.
- Esaminare immediatamente
Interpretazione del risultato del test dell’indolo

Positivo: Formazione di un colore dal rosa al rosso (“anello rosso ciliegia”) nello strato di reagente sulla parte superiore del terreno entro pochi secondi dall’aggiunta del reagente.
Esempi: Aeromonas hydrophila, Aeromonas punctata, Bacillus alvei, Edwardsiella sp., Escherichia coli, Flavobacterium sp, Haemophilus influenzae, Klebsiella oxytoca, Proteus sp. (non P. mirabilis e P. penneri), Plesiomonas shigelloides, Pasteurella multocida, Pasteurella pneumotropica, Enterococcus faecalis e Vibrio sp.
Negativo: Nessun cambiamento di colore anche dopo l’aggiunta del reagente appropriato.
Esempi: Actinobacillus spp., Aeromonas salmonicida, Alcaligenes sp., la maggior parte di Bacillus sp., Bordetella sp., Enterobacter sp., Lactobacillus spp., la maggior parte di Haemophilus sp., la maggior parte di Klebsiella sp., Neisseria sp, Pasteurella haemolytica, Pasteurella ureae, Proteus mirabilis, P. penneri, Pseudomonas sp., Salmonella sp., Serratia sp., Yersinia sp: Lo sviluppo di un colore blu entro 3 minuti.
Reazione negativa: Sviluppo di un colore rosa entro 3 minuti.
Spot Indole Test
Metodo
- Porre alcune gocce di reagente p-dimetilaminocinnamaldeide 1% su un pezzo di carta da filtro fino a saturazione.
- Con un’ansa inoculante o un bastoncino di legno, prelevare una porzione di una colonia isolata da 18-24 ore da un terreno non selettivo e strofinarla sull’area satura di reagente della carta da filtro.
- Osservare lo sviluppo del colore entro 1 o 3 minuti.
Risultati attesi
- Positivo: Una reazione positiva è indicata dalla comparsa di un cambiamento di colore da blu a blu-verde sullo striscio batterico entro 2-3 minuti.
- Negativo: Le reazioni negative rimangono incolori o rosa chiaro.
Nota: La reazione positiva è rosso-viola nel caso di Providencia alcalifaciens.
Uso dell’Indole Test
- per differenziare Proteus mirabilis (indolo negativo) da tutte le altre specie Proteus (indolo positivo).
- Per differenziare Klebssiella pneumoniae (indolo negativo) da Klebsiella oxytoca (indolo positivo).
- Per differenziare Citrobacter freundii (indolo negativo) da Citrobacter koseri (indolo positivo).
Controllo di qualità per l’Indole Test
Controllo positivo: Escherichia coli NCTC 10418
Controllo negativo: Proteus mirabilis NCTC 10975
Limitazioni del test dell’indolo
- I test dell’indolo possono essere usati come aiuto nell’identificazione e differenziazione di organismi gram-positivi e gram-negativi. Ulteriori test biochimici utilizzando colture pure sono raccomandati per un’identificazione completa.
- Il test in provetta è un metodo più sensibile per rilevare l’indolo rispetto allo spot test.
- Quando si esegue uno spot test, il reagente Kovacs Indole può essere utilizzato come sostituto del reagente dello spot test. Tuttavia, il reagente Kovacs Indole Reagent, se usato come reagente per lo spot test, è meno sensibile nel rilevare l’indolo rispetto al reagente Indole Spot Reagent (DMACA).
- Il Kovacs Indole Reagent non è raccomandato per l’uso con batteri anaerobi. Il reagente Indole Spot Reagent (DMACA) è adatto per l’uso con gli anaerobi.
- Siccome è stato dimostrato che i peptoni variano per quanto riguarda la loro idoneità all’uso nei test dell’indolo, i terreni selezionati per la determinazione dell’indolo dovrebbero essere testati con organismi noti positivi e negativi per assicurare l’idoneità.
- I terreni contenenti glucosio non dovrebbero essere usati per i test dell’indolo a causa della formazione di prodotti finali acidi che hanno dimostrato di ridurre la produzione di indolo. Anche Mueller Hinton Agar non dovrebbe essere usato per questo test perché il triptofano viene distrutto durante l’idrolisi acida della caseina.
- I terreni contenenti coloranti, come MacConkey e EMB, non sono fonti di inoculo adatte a causa del possibile trasporto del colorante e della conseguente interferenza nell’interpretazione del colore dell’indolo.
- Sono state segnalate colonie indolo-positive che fanno apparire false positive le colonie adiacenti indolo-negative a causa della diffusione dell’indolo nei terreni. Per evitare falsi positivi, selezionare colonie di diversa morfologia separate da almeno 5 mm per il test dell’indolo.