Test ten wykazuje zdolność niektórych bakterii do rozkładu aminokwasu tryptofanu do indolu, który gromadzi się w podłożu. Test produkcji indolu jest ważny w identyfikacji Enterobacteria. Większość szczepów E. coli, P. vulgaris, P. rettgeri, M. morgani i Providencia species rozkłada aminokwas tryptofan z uwolnieniem indolu. Odbywa się to za pomocą łańcucha wielu różnych enzymów wewnątrzkomórkowych, systemu ogólnie określanego jako „tryptofanaza”. Jest on używany jako część procedur IMViC, testów zaprojektowanych do rozróżniania członków rodziny Enterobacteriaceae.
Odmiana tego testu z użyciem odczynnika Ehrlicha (z użyciem alkoholu etylowego w miejsce alkoholu izoamylowego, opracowanego przez Paula Ehrlicha) jest używana podczas wykonywania testu na niefermentujących i beztlenowcach.
Zasada testu indolowego
Tryptofan jest aminokwasem, który może ulegać deaminacji i hydrolizie przez bakterie, które wykazują ekspresję enzymu tryptofanazy. Indol jest generowany przez redukcyjną deaminację tryptofanu poprzez cząsteczkę pośrednią – kwas indolopirogronowy. Tryptofanaza katalizuje reakcję deaminacji, podczas której usuwana jest grupa aminowa (-NH2) z cząsteczki tryptofanu. Produktami końcowymi reakcji są indol, kwas pirogronowy, amon (NH4+) i energia. Fosforan pirydoksalu jest wymagany jako koenzym.
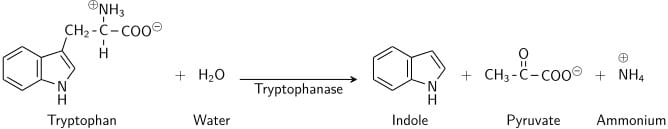
Gdy indol jest połączony z odczynnikiem Kovaca (który zawiera kwas solny i p-dimetyloaminobenzaldehyd w alkoholu amylowym), roztwór zmienia kolor z żółtego na wiśniowo-czerwony. Ponieważ alkohol amylowy nie jest rozpuszczalny w wodzie, czerwone zabarwienie utworzy się w oleistej warstwie na wierzchu bulionu.
W teście punktowym indol łączy się, w matrycy bibuły filtracyjnej, w kwaśnym pH z p-Dimetyloaminocynamaldehydem (DMACA), tworząc niebieski lub niebiesko-zielony związek. Stwierdzono, że odczynnik Indole Spot Reagent jest przydatny w wykrywaniu produkcji indolu przez członków rodziny Enterobacteriaceae i niektóre gatunki beztlenowców.
Odczynniki stosowane w teście indolowym
Składniki na litr:*
| Odczynnik Indole Spot Reagent: | |
| p-Dimetyloaminocynamaldehyd (DMACA) | 10.0 gm |
| Hydrochloric Acid, 37% | 100.0 ml |
| Woda dejonizowana | 900.0 ml |
| Odczynnik Indole Kovacsa: | |
| p-Dimetyloaminobenzaldehyd | 50.0 gm |
| Hydrochloric Acid, 37% | 250.0 ml |
| Amyl Alcohol | 750.0 ml |
* Dostosowane i/lub uzupełnione zgodnie z wymaganiami w celu spełnienia kryteriów wydajności.
Procedura testu indolowego
- Pobierz wysterylizowane probówki zawierające 4 ml bulionu tryptofanowego.
- Zakaż probówkę aseptycznie, pobierając wzrost z 18 do 24 godzin hodowli.
- Inkubuj probówkę w temperaturze 37°C przez 24-28 godzin.
- Dodaj 0,5 ml odczynnika Kovaca do hodowli bulionowej.
- Obserwuj obecność lub brak pierścienia.
Odczynnik Indole Spot (DMACA) Procedura
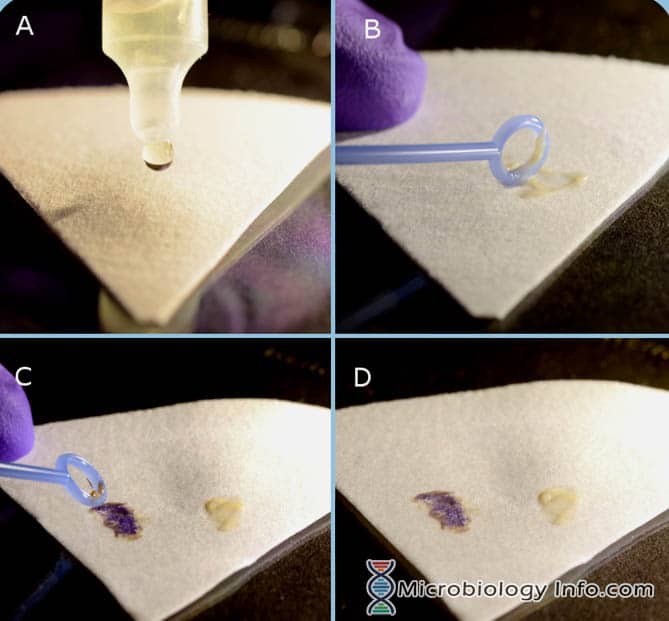
- Umieścić kilka kropli odczynnika Indole Spot Reagent na kawałku bibuły filtracyjnej.
- Przy pomocy pętli inokulacyjnej lub drewnianego patyczka aplikatora pobrać część kolonii wyizolowanej po 18-24 godzinach z nieselektywnego podłoża i wetrzeć ją w nasączony odczynnikiem obszar bibuły filtracyjnej.
- Badać natychmiast
Interpretacja wyniku testu indolowego

Dodatni: Tworzenie się różowego do czerwonego koloru („wiśniowo-czerwony pierścień”) w warstwie odczynnika na wierzchu pożywki w ciągu kilku sekund od dodania odczynnika.
Przykłady: Aeromonas hydrophila, Aeromonas punctata, Bacillus alvei,Edwardsiella sp., Escherichia coli, Flavobacterium sp., Haemophilus influenzae, Klebsiella oxytoca, Proteus sp. (nie P. mirabilis i P. penneri), Plesiomonas shigelloides, Pasteurella multocida, Pasteurella pneumotropica, Enterococcus faecalis i Vibrio sp.
Negatywny: Brak zmiany koloru nawet po dodaniu odpowiedniego odczynnika.
Przykłady: Actinobacillus spp., Aeromonas salmonicida, Alcaligenes sp., większość Bacillus sp., Bordetella sp., Enterobacter sp., Lactobacillus spp., większość Haemophilus sp., większość Klebsiella sp., Neisseria sp., Pasteurella haemolytica, Pasteurella ureae, Proteus mirabilis, P. penneri, Pseudomonas sp.,Salmonella sp., Serratia sp., Yersinia sp.
Odczynnik punktowy Indole Wynik
Reakcja dodatnia: Pojawienie się niebieskiego koloru w ciągu 3 minut.
Reakcja negatywna: Rozwój różowego zabarwienia w ciągu 3 minut.
Test Indolowy Punktowy
Metoda
- Umieścić kilka kropli 1% odczynnika p-dimetyloaminocynamaldehydu na kawałku bibuły filtracyjnej aż do nasycenia.
- Przy pomocy pętli inokulacyjnej lub drewnianego aplikatora pobrać fragment kolonii wyizolowanej w ciągu 18-24 godzin z podłoża nieselektywnego i rozetrzeć go na powierzchni bibuły filtracyjnej nasyconej odczynnikiem.
- Obserwować rozwój koloru w ciągu 1 do 3 minut.
Spodziewane wyniki
- Pozytywny: Odczyn pozytywny jest oznaczany przez pojawienie się niebieskiej lub niebiesko-zielonej zmiany koloru na rozmazie bakteryjnym w ciągu 2-3 minut.
- Odczyn negatywny: Reakcje ujemne pozostają bezbarwne lub jasnoróżowe.
Uwaga: Reakcja dodatnia jest czerwono-fioletowa w przypadku Providencia alcalifaciens.
Zastosowanie testu indolowego
- Do różnicowania Proteus mirabilis (indol ujemny) od wszystkich innych gatunków Proteus (indol dodatni).
- Do różnicowania Klebssiella pneumoniae (indol ujemny) od Klebsiella oxytoca (indol dodatni).
- Do różnicowania Citrobacter freundii (indol ujemny) od Citrobacter koseri (indol dodatni).
Kontrola jakościowa dla testu indolowego
Kontrola dodatnia: Escherichia coli NCTC 10418
Kontrola ujemna: Proteus mirabilis NCTC 10975
Ograniczenia Testu Indolowego
- Testy indolowe mogą być stosowane jako pomoc w identyfikacji i różnicowaniu organizmów gram-dodatnich i gram-ujemnych. W celu pełnej identyfikacji zaleca się przeprowadzenie dodatkowych badań biochemicznych z użyciem czystych kultur.
- Test probówkowy jest bardziej czułą metodą wykrywania indolu niż test punktowy.
- Podczas wykonywania testu punktowego, odczynnik Kovacs Indole Reagent może być użyty jako substytut odczynnika do testu punktowego. Jednakże, odczynnik indolowy Kovacsa, stosowany jako odczynnik do testu plamkowego, jest mniej czuły w wykrywaniu indolu niż odczynnik indolowy (DMACA).
- Odczynnik indolowy Kovacsa nie jest zalecany do stosowania z bakteriami beztlenowymi. Odczynnik Indole Spot Reagent (DMACA) jest odpowiedni do stosowania z bakteriami beztlenowymi.
- Ponieważ wykazano, że peptony różnią się pod względem przydatności do badania indolu, podłoża wybrane do oznaczania indolu powinny być badane ze znanymi organizmami dodatnimi i ujemnymi, aby zapewnić ich przydatność.
- Podłoża zawierające glukozę nie powinny być stosowane do badania indolu ze względu na tworzenie się kwaśnych produktów końcowych, które, jak wykazano, zmniejszają produkcję indolu. Podłoże Mueller Hinton Agar również nie powinno być używane do tego badania, ponieważ tryptofan jest niszczony podczas kwaśnej hydrolizy kazeiny.
- Podłoża zawierające barwnik, takie jak MacConkey i EMB, są nieodpowiednimi źródłami inokulum ze względu na możliwe przeniesienie barwnika i późniejsze zakłócenie interpretacji koloru indolu.
- Odnotowano, że kolonie indolododatnie powodują, że sąsiednie kolonie indolo-ujemne wydają się fałszywie dodatnie z powodu dyfuzji indolu do podłoża. Aby uniknąć wyników fałszywie dodatnich, do badania indolowego należy wybrać kolonie o różnej morfologii, oddzielone od siebie o co najmniej 5 mm.
.