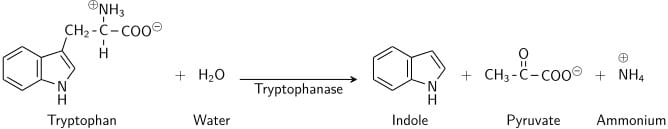
このテストは、特定の細菌がアミノ酸のトリプトファンを分解してインドールに変換し、培地中に蓄積する能力を示すものです。 インドール産生試験は、腸内細菌の同定に重要です。 E. coli、P. vulgaris、P. rettgeri、M. morgani、Providencia種のほとんどの菌株は、インドールを放出しながらアミノ酸のトリプトファンを分解する。 これは、いくつかの異なる細胞内酵素の連鎖によって行われ、一般的には “トリプトファナーゼ “と呼ばれるシステムです。
非発酵菌や嫌気性菌の検査には、Ehrlich試薬(Paul Ehrlichが開発したイソアミルアルコールの代わりにエチルアルコールを使用した試薬)を用いたバリエーションがあります。
インドールテストの原理
トリプトファンはアミノ酸の一種であり、トリプトファナーゼ酵素を発現する細菌によって脱アミノ化と加水分解を受けることができる。 インドールは、トリプトファンから中間体であるインドールピルビン酸を介して還元的脱アミノ化により生成される。 トリプトファナーゼは、トリプトファン分子のアミン(-NH2)基が除去される脱アミノ化反応を触媒する。 この反応の最終生成物は、インドール、ピルビン酸、アンモニウム(NH4+)、エネルギーである。
インドールをKovac’s Reagent(塩酸とp-ジメチルアミノベンズアルデヒドをアミルアルコールに溶かしたもの)と合わせると、溶液は黄色から桜色に変わります。
スポットテストでは、インドールは濾紙マトリックス中で酸性のpHでp-ジメチルアミノシンナムアルデヒド(DMACA)と結合し、青から青緑色の化合物を生成します。 インドールスポット試薬は、腸内細菌科のメンバーやある種の嫌気性生物によるインドールの生産を検出するのに有用であると報告されています。
インドールテストに使用される試薬
1リットルあたりの成分:*
| インドールスポット試薬。 | |
| p-Dimethylaminocinnamaldehyde (DMACA) | 10.0gm |
| Hydrochloric Acid, 37% | 100.0 ml |
| 脱イオン水 | 900.0 ml |
| Indole Kovacs Reagent: | |
| p-Dimethylaminobenzaldehyde | 50.0gm |
| Hydrochloric Acid, 37% | 250.0 ml |
| Amyl Alcohol | 750.0 ml |
*性能基準を満たすために、必要に応じて調整および/または補充する
インドール試験の手順
- トリプトファンブロス4 mlを入れた滅菌済み試験管を用意する。
- 18~24時間培養したものを無菌的に接種する。
- 37℃で24~28時間培養する。
- ブロス培養液に0.5mlのKovac試薬を加える。
- リングの有無を観察する。
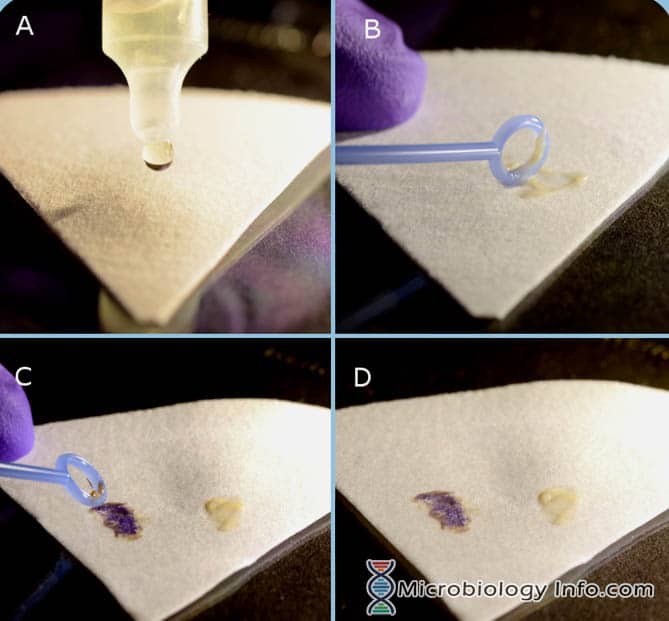
インドールスポット試薬(DMACA)の手順
- インドールスポット試薬をろ紙に数滴垂らす。
- 接種用ループや木製のアプリケータースティックを用いて、非選択培地から18~24時間隔離されたコロニーの一部を採取し、ろ紙の試薬が飽和している部分にこすりつける。
- すぐに検査する
インドールテストの結果解釈

陽性である。 試薬を加えてから数秒以内に、培地上の試薬層にピンクから赤の色調(「桜色リング」)が形成されること。
例。 Aeromonas hydrophila、Aeromonas punctata、Bacillus alvei、Edwardsiella sp.、Escherichia coli、Flavobacterium sp.など。 Haemophilus influenzae、Klebsiella oxytoca、Proteus sp.(P. mirabilisとP. penneriを除く)、Plesiomonas shigelloides、Pasteurella multocida、Pasteurella pneumotropica、Enterococcus faecalis、Vibrio sp.
陰性。
陰性:適切な試薬を加えても色の変化がないこと。
例。 アクチノバシラス属、アエロモナス・サルモニシダ、アルカリゲネス属、ほとんどのバシラス属、ボルデテラ属、エンテロバクター属、ラクトバシラス属、ほとんどのヘモフィルス属、ほとんどのクレブシエラ属、ナイセリア属、パスツレラ属。 Pasteurella haemolytica, Pasteurella ureae, Proteus mirabilis, P. penneri, Pseudomonas sp., Salmonella sp., Serratia sp., Yersinia sp.
インドールスポット試薬の結果
陽性反応です。
陰性反応:3分以内に青く発色する。
Spot Indole Test
Method
- 1% p-dimethylaminocinnamaldehyde試薬を数滴、ろ紙の上に飽和するまで置く。
- 接種用ループまたは木製アプリケータースティックを用いて、非選択培地から18~24時間隔離されたコロニーの一部を選び、ろ紙の試薬が飽和する部分にこすりつける。
- 1~3分以内に発色するかどうかを観察する。
期待される結果
- 陽性。 陽性反応は、2~3分以内に細菌の塗抹標本に青色から青緑色の変化が現れることで示されます。
- 陰性。
インドールテストの用途
- Proteus mirabilis(インドール陰性)と他のすべてのProteus種(インドール陽性)を鑑別する。
- Klebssiella pneumoniae(インドール陰性)とKlebsiella oxytoca(インドール陽性)との鑑別
- Citrobacter freundii(インドール陰性)とCitrobacter koseri(インドール陽性)との鑑別
インドール試験の品質管理
陽性対照。 Escherichia coli NCTC 10418
Negative Control: Proteus mirabilis NCTC 10975
インドール試験の限界
- インドール試験は、グラム陽性菌とグラム陰性菌の同定・鑑別の一助として用いることができる。
- チューブテストはスポットテストよりもインドールを検出する感度の高い方法である。
- スポットテストを行う際に、コバックスインドール試薬をスポットテスト試薬の代わりに使用することができる。 しかし、Kovacsインドール試薬をスポットテスト試薬として使用した場合、インドールスポット試薬(DMACA)よりもインドールの検出感度が低くなります。
- Kovacsインドール試薬は嫌気性細菌への使用は推奨されません。
- インドールスポット試薬(DMACA)は嫌気性菌の使用に適しています。
- ペプトンはインドール試験での使用に適しているかどうかに関して異なることが示されているので、インドール測定用に選択された培地は、適合性を保証するために既知の陽性および陰性の生物でテストする必要があります。
- グルコースを含む培地は、インドール産生を減少させることが示されている酸の最終生成物の形成のため、インドール試験に使用すべきではありません。
- MacConkeyやEMBなどの色素を含む培地は、色素がキャリーオーバーしてインドールの色の解釈に支障をきたす可能性があるため、接種源としては適していません。
- インドール陽性のコロニーは、培地中へのインドールの拡散により、隣接するインドール陰性のコロニーを偽陽性に見せることが報告されています。 偽陽性を避けるためには、形態の異なるコロニーを5mm以上離してインドール検査を行うようにしてください。