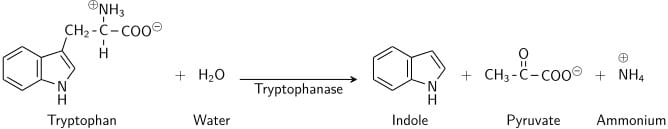
Deze test toont het vermogen van bepaalde bacteriën aan om het aminozuur tryptofaan af te breken tot indool, dat zich ophoopt in het medium. De indoolproductietest is belangrijk voor de identificatie van Enterobacteriën. De meeste stammen van E. coli, P. vulgaris, P. rettgeri, M. morgani en Providencia species breken het aminozuur tryptofaan af waarbij indool vrijkomt. Dit gebeurt door een keten van een aantal verschillende intracellulaire enzymen, een systeem dat in het algemeen “tryptofanase” wordt genoemd. De test wordt gebruikt als onderdeel van de IMViC-procedures, een test die is ontworpen om onderscheid te maken tussen leden van de familie Enterobacteriaceae.
Een variatie op deze test met Ehrlichs reagens (waarbij ethylalcohol wordt gebruikt in plaats van isoamylalcohol, ontwikkeld door Paul Ehrlich) wordt gebruikt wanneer de test wordt uitgevoerd op niet-fermenteerders en anaëroben.
Principe van de indooltest
Tryptofaan is een aminozuur dat kan worden gedeamineerd en gehydrolyseerd door bacteriën die het tryptofanase-enzym tot expressie brengen. Indool wordt gegenereerd door reductieve deaminatie van tryptofaan via het tussenliggende molecuul indolpyrodruivenzuur. Tryptofanase katalyseert de deaminatiereactie, waarbij de amine (-NH2)-groep van het tryptofaanmolecuul wordt verwijderd. Eindproducten van de reactie zijn indool, pyrodruivenzuur, ammonium (NH4+) en energie. Als co-enzym is pyridoxalfosfaat nodig.
Wanneer indool wordt gecombineerd met Kovac’s Reagens (dat zoutzuur en p-dimethylaminobenzaldehyde in amylalcohol bevat) kleurt de oplossing van geel naar kersenrood. Omdat amylalcohol niet in water oplosbaar is, vormt de rode kleur zich in een olieachtige laag boven in de bouillon.
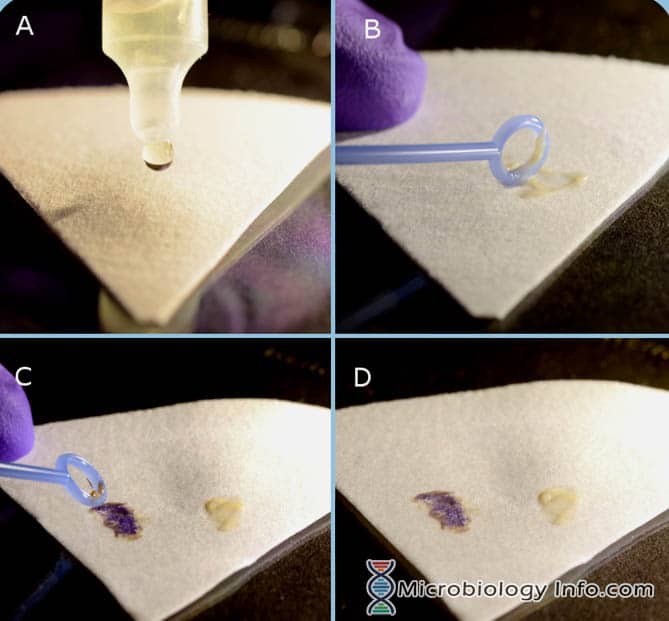
In de spottest combineert indool, in de matrix van filtreerpapier, bij een zure pH met p-Dimethylaminocinnamaldehyde (DMACA) om een blauwe tot blauwgroene verbinding te produceren. Indole Spot Reagent is naar verluidt nuttig voor het opsporen van indoolproductie door leden van de familie Enterobacteriaceae en bepaalde anaerobe soorten.
Gebruikte reagentia in indooltest
Ingrediënten per liter:*
| Indole Spot Reagent: | |
| p-Dimethylaminocinnamaldehyde (DMACA) | 10.0 gm |
| Hydrochloric Acid, 37% | 100.0 ml |
| Geïoniseerd water | 900.0 ml |
| Indole Kovacs Reagent: | |
| p-Dimethylaminobenzaldehyde | 50.0 gm |
| Hydrochloorzuur, 37% | 250,0 ml |
| Amyl Alcohol | 750.0 ml |
* Aangepast en/of aangevuld indien nodig om aan de prestatiecriteria te voldoen.
Procedure van de indooltest
- Neem een gesteriliseerde reageerbuis met 4 ml tryptofaanbouillon.
- Inoculeer de buis aseptisch door de groei van 18 tot 24 uur cultuur te nemen.
- Incubeer de buis bij 37°C gedurende 24-28 uur.
- Voeg 0,5 ml Kovac’s reagens toe aan de bouilloncultuur.
- Observeer voor de aan- of afwezigheid van ring.
Indole Spot Reagent (DMACA) Procedure
- Plaats enkele druppels Indole Spot Reagent op een stuk filtreerpapier.
- Pluk met een inoculatielusje of houten applicatorstokje een gedeelte van een 18-24 uur geïsoleerde kolonie van een niet-selectief medium en wrijf dit op het met reagens verzadigde gedeelte van het filtreerpapier.
- Onmiddellijk onderzoeken
Interpretatie van het resultaat van de indolentest

Positief: Vorming van een roze tot rode kleur (“kersenrode ring”) in de reagenslaag bovenop het medium binnen enkele seconden na toevoeging van het reagens.
Voorbeelden: Aeromonas hydrophila, Aeromonas punctata, Bacillus alvei,Edwardsiella sp., Escherichia coli, Flavobacterium sp., Haemophilus influenzae, Klebsiella oxytoca, Proteus sp. (niet P. mirabilis en P. penneri), Plesiomonas shigelloides,Pasteurella multocida, Pasteurella pneumotropica, Enterococcus faecalis, en Vibrio sp.
Negatief: Geen kleurverandering, ook niet na toevoeging van het juiste reagens.
Voorbeelden: Actinobacillus spp., Aeromonas salmonicida, Alcaligenes sp., de meeste Bacillus sp., Bordetella sp., Enterobacter sp., Lactobacillus spp., de meeste Haemophilus sp., de meeste Klebsiella sp., Neisseria sp., Pasteurella haemolytica, Pasteurella ureae, Proteus mirabilis, P. penneri, Pseudomonas sp.,Salmonella sp., Serratia sp., Yersinia sp.
Indole Spot Reagent Resultaat
Positieve reactie: De ontwikkeling van een blauwe kleur binnen 3 minuten.
Negatieve reactie: De ontwikkeling van een roze kleur binnen 3 minuten.
Spot Indole Test
Methode
- Plaats enkele druppels 1% p-dimethylaminocinnamaldehyde reagens op een stukje filtreerpapier tot verzadiging.
- Pluk met een inoculatielus of houten applicatorstokje een deel van een 18-24 uur geïsoleerde kolonie van een niet-selectief medium en wrijf dit over het met reagens verzadigde deel van het filtreerpapier.
- Observeer de kleurontwikkeling binnen 1 tot 3 minuten.
Verwachte resultaten
- Positief: Een positieve reactie wordt aangegeven door het verschijnen van een blauwe tot blauwgroene kleurverandering op de bacteriële uitstrijk binnen 2-3 minuten.
- Negatief: Negatieve reacties blijven kleurloos of lichtroze.
Note: Positieve reactie is roodviolet in het geval van Providencia alcalifaciens.
Toepassingen van Indole Test
- Om Proteus mirabilis (indole negatief) te onderscheiden van alle andere Proteus soorten (indole positief).
- Klebssiella pneumoniae (indoolnegatief) van Klebsiella oxytoca (indoolpositief) te onderscheiden.
- Citrobacter freundii (indoolnegatief) van Citrobacter koseri (indoolpositief) te onderscheiden.
Kwaliteitscontrole voor indooltest
Positieve controle: Escherichia coli NCTC 10418
Negatieve controle: Proteus mirabilis NCTC 10975
Beperkingen van de indolentest
- Indole tests kunnen worden gebruikt als hulpmiddel bij de identificatie en differentiatie van gram-positieve en gram-negatieve organismen. Voor een volledige identificatie wordt aanvullend biochemisch onderzoek met behulp van reinculturen aanbevolen.
- De buisjestest is een gevoeligere methode voor het opsporen van indool dan de spottest.
- Bij het uitvoeren van een spottest kan Kovacs Indole Reagent worden gebruikt als vervanging voor het spottestreagens. Kovacs Indole Reagent is bij gebruik als spottestreagens echter minder gevoelig voor het opsporen van indool dan het Indole Spot Reagent (DMACA).
- Kovacs Indole Reagent wordt niet aanbevolen voor gebruik met anaerobe bacteriën. Het Indole Spot Reagent (DMACA) is geschikt voor gebruik met anaerobe bacteriën.
- Omdat is aangetoond dat peptonen verschillen wat betreft hun geschiktheid voor gebruik met indooltests, moeten voor indoolbepaling geselecteerde media worden getest met bekende positieve en negatieve organismen om de geschiktheid te verzekeren.
- Glucosehoudende media mogen niet voor indooltests worden gebruikt wegens de vorming van zure eindproducten waarvan is aangetoond dat zij de indoolproductie verminderen. Mueller Hinton Agar mag evenmin voor deze test worden gebruikt omdat tryptofaan tijdens de zure hydrolyse van caseïne wordt vernietigd.
- Kleurstofhoudende media, zoals MacConkey en EMB, zijn ongeschikte bronnen van inoculum wegens mogelijke carry-over van kleurstof en de daaropvolgende interferentie van de indoolkleuropvatting.
- Indole-positieve kolonies kunnen er naar verluidt toe leiden dat aangrenzende indool-negatieve kolonies vals-positief lijken wegens diffusie van indool in de media. Om vals-positieve resultaten te voorkomen, selecteert u voor de indooltest kolonies met een verschillende morfologie die ten minste 5 mm van elkaar verwijderd zijn.