Este teste demonstra a capacidade de certas bactérias decomporem o aminoácido triptofano em indole, que se acumula no meio. O teste de produção de Indole é importante para a identificação de Enterobacteria. A maioria das estirpes das espécies E. coli, P. vulgaris, P. rettgeri, M. morgani e Providencia decompõem o aminoácido triptofano com a libertação do indole. Isto é realizado por uma cadeia de várias enzimas intracelulares diferentes, um sistema geralmente referido como “triptofanase”. É utilizado como parte dos procedimentos IMViC,um teste concebido para distinguir entre os membros da família Enterobacteriaceae.
Uma variação neste teste utilizando o reagente de Ehrlich (utilizando álcool etílico em vez de álcool isoamílico, desenvolvido por Paul Ehrlich) é utilizado quando se realiza o teste em não fermentadores e anaeróbios.
Princípio do teste de Indole
Tryptophan é um aminoácido que pode sofrer desaminação e hidrólise por bactérias que exprimem a enzima triptofanase. O indolo é gerado por desaminação redutora do triptofano através da molécula intermédia ácido indolepirúvico. A triptofanase catalisa a reacção de desaminação, durante a qual o grupo amina (-NH2) da molécula de triptofano é removido. Os produtos finais da reacção são o indole, o ácido pirúvico, o amónio (NH4+) e a energia. O fosfato piridoxal é necessário como coenzima.
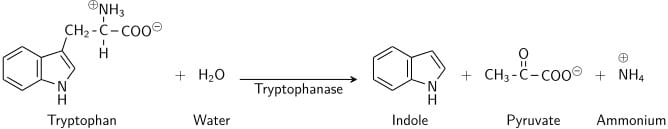
Quando o indole é combinado com o Reagente de Kovac (que contém ácido clorídrico e p-dimetilaminobenzaldeído em álcool amílico) a solução passa de amarelo para vermelho cereja. Como o álcool amílico não é solúvel em água, a coloração vermelha forma-se numa camada oleosa no topo do caldo.
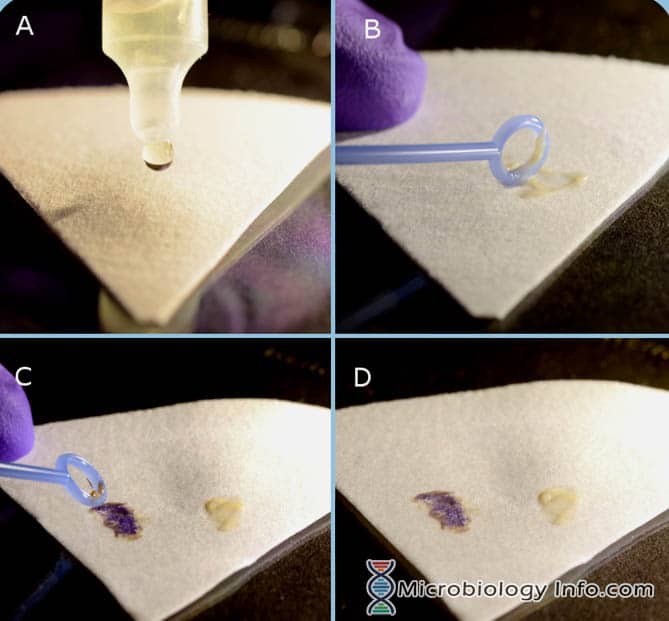
No teste spot, o indole combina, na matriz de papel filtro, um pH ácido com p-dimetilaminocinamaldeído (DMACA) para produzir um composto azul a azul-esverdeado. O Indole Spot Reagent foi relatado como sendo útil na detecção da produção de indole por membros da família Enterobacteriaceae e certas espécies anaeróbias.
Reagentes utilizados no teste de Indole
Ingredientes por litro:*
| p-Dimetilaminocinamaldeído (DMACA) | 10.0 gm |
| Ácido clorídrico, 37% | 100.0 ml |
| Água Desionizada | 900.0 ml |
| Indole Kovacs Reagent: | |
| p-Dimetilaminobenzaldeído | 50.0 gm |
| Ácido clorídrico, 37% | 250.0 ml |
| 750.0 ml | |
* Ajustado e/ou suplementado conforme necessário para cumprir os critérios de desempenho.
Procedimento do Teste Indolétrico
- Tomar um tubo de ensaio esterilizado contendo 4 ml de caldo de triptofano.
- Incubar o tubo a 37°C durante 24-28 horas.
- Observar para a presença ou ausência de anel.
Inocule o tubo assepticamente levando o crescimento de 18 a 24 horas de cultura.
Adicionar 0,5 ml de reagente de Kovac à cultura do caldo.
Reagente de Indole Spot (DMACA) Procedimento
- Colocar várias gotas de Reagente de Indole Spot sobre um pedaço de papel de filtro.
- Com um laço inoculante ou bastão aplicador de madeira, recolher uma porção de uma colónia isolada de 18-24 horas a partir de um meio não selectivo e esfregá-la na área saturada do reagente do papel de filtro.
- Examinar imediatamente
Resultado Interpretação do Teste Indolétrico
 Resultado Interpretação do Teste Indolétrico
Resultado Interpretação do Teste Indolétrico
Positivo: Formação de uma cor rosa a vermelha (“anel vermelho-cereja”) na camada de reagente no topo do meio em segundos após a adição do reagente.
Exemplos: Aeromonas hydrophila, Aeromonas punctata, Bacillus alvei,Edwardsiella sp., Escherichia coli, Flavobacterium sp.., Haemophilus influenzae, Klebsiella oxytoca, Proteus sp. (não P. mirabilis e P. penneri), Plesiomonas shigelloides,Pasteurella multocida, Pasteurella pneumotropica, Enterococcus faecalis, e Vibrio sp.
Negativo: Sem mudança de cor mesmo após a adição de reagente apropriado.
Exemplos: Actinobacillus spp., Aeromonas salmonicida, Alcaligenes sp., a maioria Bacillus sp., Bordetella sp., Enterobacter sp., Lactobacillus spp., a maioria Haemophilus sp., a maioria Klebsiella sp., Neisseria sp, Pasteurella hemolítica, Pasteurella ureae, Proteus mirabilis, P. penneri, Pseudomonas sp.,Salmonella sp., Serratia sp., Yersinia sp.
Reagente Indolégiro Resultado
Reacção positiva: O desenvolvimento de uma cor azul em 3 minutos.
Reacção negativa: O desenvolvimento de uma cor rosa dentro de 3 minutos.
Teste Indolo de Ponto
Método
- Colocar várias gotas de reagente de 1% p-dimetilaminocinamaldeído num pedaço de papel de filtro até à saturação.
- Com um laço inoculante ou bastão aplicador de madeira, colher uma porção de uma colónia isolada de 18-24 horas de um meio não selectivo e esfregá-la na área saturada de reagente do papel de filtro.
- Observar para o desenvolvimento da cor dentro de 1 a 3 minutos.
Resultados esperados
- Positivo: Uma reacção positiva é denotada pelo aparecimento de uma mudança de cor azul a azul-verde no esfregaço bacteriano dentro de 2-3 minutos.
- Negativo: As reacções negativas permanecem sem cor ou rosa claro.
Nota: A reacção positiva é vermelho-violeta no caso de Providencia alcalifaciens.
Uses of Indole Test
- Para diferenciar Proteus mirabilis (indole negativo) de todas as outras espécies de Proteus (indole positivo).
- Para diferenciar Klebssiella pneumoniae (indole negativo) de Klebsiella oxytoca (indole positivo).
- Testes de Indolação podem ser utilizados como ajuda na identificação e diferenciação de organismos gram-positivos e gram-negativos. Recomenda-se a realização de testes bioquímicos adicionais utilizando culturas puras para uma identificação completa.
- O teste em tubo é um método mais sensível de detecção do indole do que o teste spot.
- Ao realizar um teste spot, o Reagente Indol Kovacs pode ser utilizado como um substituto do reagente do teste spot. Contudo, o Reagente Indol Kovacs, quando usado como reagente de teste pontual, é menos sensível na detecção do indole do que o Reagente Indolétrico (DMACA).
- Kovacs Indole Reagent não é recomendado para uso com bactérias anaeróbias. O Reagente Indole Spot (DMACA) é adequado para utilização com anaeróbios.
- Peptones demonstraram variar em relação à sua aptidão para utilização com testes de indole, os meios seleccionados para determinação de indole devem ser testados com organismos positivos e negativos conhecidos para assegurar a sua aptidão.
- Os meios contendo glucose não devem ser utilizados para testes de indole devido à formação de produtos finais ácidos que demonstraram reduzir a produção de indole. Mueller Hinton Agar também não deve ser utilizado para este teste porque o triptofano é destruído durante a hidrólise ácida da caseína.
- Colónias indolo-positivas têm sido relatadas como fazendo com que colónias adjacentes indole-negativas pareçam falso-positivas devido à difusão do indole nos meios de comunicação. Para evitar falso-positivos, seleccionar colónias de morfologias diferentes que são separadas por pelo menos 5mm para testes de indole.
li> Para diferenciar Citrobacter freundii (indole negativo) de Citrobacter koseri (indole positivo).
Controlo de Qualidade para a Prova de Indolicidade
Controlo Positivo: Escherichia coli NCTC 10418
Controlo Negativo: Proteus mirabilis NCTC 10975
Limitações do Teste de Indolação
>Meios contendo corante, tais como MacConkey e EMB, são fontes inadequadas de inóculo devido à possível transferência de corante e subsequente interferência da interpretação da cor indole.